题目内容
【题目】浩瀚的大海里蕴藏着丰富的资源,开发海水资源前景广阔,探究学习小组以含有Ca2+ , Mg2+ , Cl﹣离子的卤水和贝壳(主要成分为CaCO3)为主要原料在实验室制备无水CaCl2 , 流程如图所示: 
请回答下列问题:
(1)操作Ⅰ中的名称是 , 该操作中玻璃棒的作用是 .
(2)以MgCl2为例,写出卤水中除去Mg2+时发生反应的化学方程式 .
(3)操作Ⅱ酸化时应选择的酸是(填“稀盐酸”或“稀硫酸”).
(4)海水是天然巨大的“盐库”,我们吃的食盐大都来自海水晒盐,海水晒盐的主要原理是 .
【答案】
(1)过滤;引流
(2)MgCl2+Ca(OH)2=CaCl2+Mg(OH)2↓
(3)稀盐酸
(4)蒸发结晶
【解析】解:(1)操作Ⅰ是分离固体与液体的方法,是过滤;在过滤操作中,玻璃棒的作用是引流;故填:过滤;引流;(2)由反应的流程可知,除去Mg2+时,加氢氧化钙,氯化镁转化为氢氧化镁的反应是氯化镁与氢氧化钙反应生成了氢氧化镁沉淀和氯化钙,反应的化学方程式是:MgCl2+Ca(OH)2=CaCl2+Mg(OH)2↓;故填:MgCl2+Ca(OH)2=CaCl2+Mg(OH)2↓;(3)该过程是制取CaCl2 , Ⅱ中的酸只能是盐酸;故填:稀盐酸;(4)氯化钠的溶解度受温度影响比较小,所以海水晒盐的原理是蒸发结晶.故填:蒸发结晶.
(1)根据分离混合物的方法以及仪器的用途来分析;(2)根据氯化镁转化为氢氧化镁的反应,写出反应的化学方程式;(3)根据该过程是制取CaCl2 , Ⅱ中的酸只能是盐酸;(4)根据氯化钠的溶解度受温度的影响来分析.

【题目】某学习小组探究氢氧化钙溶液的化学性质,并作了延伸探究.
(1)探究一:甲同学设计了如下实验方案,请你帮助完成实验报告.
方案 | (1) | (2) | (3) |
实验操作 |
|
|
|
现象 | 澄清石灰水变浑浊 | 红色褪为无色 | |
结论或解释 | 氢氧化钙溶液能使石蕊等酸碱指示剂变色 | 氢氧化钙溶液能与某些非金属氧化物反应生成盐和水.二氧化硫与澄清石灰水反应的化学方程式是 | 氢氧化钙溶液能与酸发生中和反应 |
【提出问题】实验方案(3)褪色后溶液中的溶质是什么?
【查阅资料】CaCl2溶液呈中性.
【作出猜想】乙同学从反应情况分析,溶液中除含少量酚酞外,溶质可能有以下三种情况:
①CaCl2;②CaCl2和HCl;③CaCl2和Ca(OH)2
【分析讨论】丙同学从实验现象分析得出:猜想③肯定不合理,其理由是 .
(2)探究二:
丁同学为进一步验证乙同学的猜想,设计实验如下:将实验方案(3)褪色后溶液倒入烧杯中,向其中逐滴滴加稀碳酸钠溶液至过量,边滴边振荡.实验后得出产生沉淀质量与滴加碳酸钠溶液体积之间的关系,如图所示.写出实验过程中的现象 . 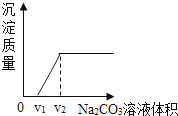
【得出结论】乙同学的猜想中, (填序号)合理.
【反思讨论】
学习小组结合图象,分析了丁同学实验过程中烧杯内溶液的变化.下列说法正确的是 .(填序号)
A.溶液质量逐渐增大 B.氯化钠质量逐渐增大,V2后不变
C.氯化钙的质量先增大后减小 D.溶液的pH一直在增大.