题目内容
钢铁工业是国家工业的基础.2008年我国粗钢产量近5亿吨,居世界首位,某中学社会实践活动小组利用假期对当地钢铁厂进行了调研,对从矿石开始到钢铁产出的工艺流程有了全面的感性认识.请你回答下列社会实践活动小组感兴趣的问题:(1)将6.62g铁矿石样品投入适量的盐酸中(充分反应),过滤,然后在滤液中加过量的NaOH 溶液,充分反应后,过滤、洗涤、灼烧得4.80g Fe2O3.现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00t生铁(含铁96%),至少需要这种铁矿石多少吨?(保留两位小数)
(2)取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,将产生的气体通入足量的澄清石灰水中,得到1g白色沉淀.
①计算此钢样粉末中铁和碳的质量之比.
②再取三份不同质量的钢样粉末分别加到50g质量分数相同的稀H2SO4中,充分反应后,测得的实验数据如下表所示:(标准状况下,2gH2的体积为22.4L)
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 加入钢样粉末的质量/g | 2.812 | 5.624 | 8.436 |
| 生成气体的体积/L(标准状况) | 1.120 | 2.240 | 2.800 |
③若在实验Ⅱ中继续加入mg钢样粉末,计算反应结束后剩余的固体质量为多少?(用含m的代数式表示)
【答案】分析:(1)根据Fe2O3的分子式计算出铁元素的质量分数,然后求得6.62g铁矿石中铁的质量;再根据已知条件“若生产过程中铁元素损失4%,计算每生产1.00t生铁(含铁96%)”计算生产1.00t生铁需铁矿石的质量;
(2)①钢样中的C元素燃烧后生成二氧化碳,二氧化碳通入澄清石灰水生成了碳酸钙沉淀,根据化学变化中元素质量不变,碳酸钙中所含C元素质量即钢样中C元素质量;由此可完成此钢样粉末中铁和碳的质量之比的计算;
②分析表中所记录实验数据,可得知在第III次实验中稀硫酸完全反应,根据反应的化学方程式.由生成氢气质量计算50g稀硫酸中硫酸的质量,解决硫酸中H2SO4的质量分数.
③要分类讨论:当Fe完全反应;当Fe过量时.
解答:解:(1)解:6.62g铁矿石中铁的质量为mFe=4.80g×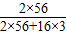 =3.36g
=3.36g
生产1.00t生铁需铁矿石的质量为:m铁矿石=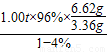 ≈1.97t
≈1.97t
答:至少需要这种铁矿石1.97t
(2)①根据题意知,该白色沉淀是CaCO3,所以C的质量=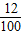 ×100%×1g=0.12g;
×100%×1g=0.12g;
故此钢样粉末中铁的质量=28.12g-0.12g=28g;
所以此钢样粉末中铁和碳的质量之比=28:0.12=700:3;
②设50g稀硫酸中溶质的质量为x
Fe+H2SO4=FeSO4+H2↑
98 2
x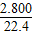 ×2g
×2g
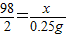
x=12.25g
稀硫酸中H2SO4的质量分数为: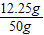 ×100%=24.5%
×100%=24.5%
③当钢样粉末中的铁末全部溶解时(m>1.406g),剩余的固体质量为:(5.624g+mg)-0.125mol×56g?mol-1=(m-1.376)g
当钢样粉末中的铁全部溶解时(m≤1.406g),
剩余的固体质量为:(5.624+m)g× ;
;
答:①此钢样粉末中铁和碳的质量之比是700:3;
②稀硫酸中H2SO4的质量分数是24.5%(2分);
③当m>1.406 g,剩余固体质量为:(m-1.376)g (2分)
当 m≤1.406 g,剩余固体质量为:(5.624+m)×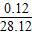 g (2分)
g (2分)
点评:根据实验数据中钢样质量的增加值与反应产生氢气的质量增加值的关系,判断实验III中稀硫酸完全反应是计算稀硫酸溶质质量分数的根本.
(2)①钢样中的C元素燃烧后生成二氧化碳,二氧化碳通入澄清石灰水生成了碳酸钙沉淀,根据化学变化中元素质量不变,碳酸钙中所含C元素质量即钢样中C元素质量;由此可完成此钢样粉末中铁和碳的质量之比的计算;
②分析表中所记录实验数据,可得知在第III次实验中稀硫酸完全反应,根据反应的化学方程式.由生成氢气质量计算50g稀硫酸中硫酸的质量,解决硫酸中H2SO4的质量分数.
③要分类讨论:当Fe完全反应;当Fe过量时.
解答:解:(1)解:6.62g铁矿石中铁的质量为mFe=4.80g×
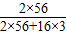 =3.36g
=3.36g 生产1.00t生铁需铁矿石的质量为:m铁矿石=
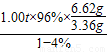 ≈1.97t
≈1.97t答:至少需要这种铁矿石1.97t
(2)①根据题意知,该白色沉淀是CaCO3,所以C的质量=
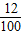 ×100%×1g=0.12g;
×100%×1g=0.12g;故此钢样粉末中铁的质量=28.12g-0.12g=28g;
所以此钢样粉末中铁和碳的质量之比=28:0.12=700:3;
②设50g稀硫酸中溶质的质量为x
Fe+H2SO4=FeSO4+H2↑
98 2
x
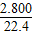 ×2g
×2g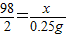
x=12.25g
稀硫酸中H2SO4的质量分数为:
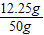 ×100%=24.5%
×100%=24.5%③当钢样粉末中的铁末全部溶解时(m>1.406g),剩余的固体质量为:(5.624g+mg)-0.125mol×56g?mol-1=(m-1.376)g
当钢样粉末中的铁全部溶解时(m≤1.406g),
剩余的固体质量为:(5.624+m)g×
 ;
;答:①此钢样粉末中铁和碳的质量之比是700:3;
②稀硫酸中H2SO4的质量分数是24.5%(2分);
③当m>1.406 g,剩余固体质量为:(m-1.376)g (2分)
当 m≤1.406 g,剩余固体质量为:(5.624+m)×
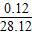 g (2分)
g (2分)点评:根据实验数据中钢样质量的增加值与反应产生氢气的质量增加值的关系,判断实验III中稀硫酸完全反应是计算稀硫酸溶质质量分数的根本.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
钢铁工业是国家工业的基础.2007年我国粗钢产量接近5亿吨,居世界前列.湛江的东海岛也将建设千万吨钢铁厂,这将给湛江的经济带来质的飞跃.某校兴趣小组取某种钢样进行试验,请计算:
(1)取钢样(假设只含铁单质和碳单质)粉末100g,在氧气中充分燃烧,得到CO2气体4.4g,此钢样粉末中碳的质量分数为 (保留到0.1%).
(2)分别向四份不同质量的钢样粉末中加入100g稀硫酸溶液,充分反应后,测得的实验数据如下表所示:
①计算硫酸溶液中溶质的质量 g
②求在实验3中反应后所得的溶液中溶质的质量分数?
(1)取钢样(假设只含铁单质和碳单质)粉末100g,在氧气中充分燃烧,得到CO2气体4.4g,此钢样粉末中碳的质量分数为
(2)分别向四份不同质量的钢样粉末中加入100g稀硫酸溶液,充分反应后,测得的实验数据如下表所示:
序数 质量 |
实验1 | 实验2 | 实验3 | 实验4 |
| 钢样粉末质量 | 2.84g | 4.25g | 6.23g | 7.51g |
| 生成H2的质量 | 0.10g | 0.15g | 0.20g | 0.20g |
②求在实验3中反应后所得的溶液中溶质的质量分数?
钢铁工业是国家工业的基础。2007年我国粗钢产量接近5亿吨,居世界前列。湛江的东海岛也将建设千万吨钢铁厂,这将给湛江的经济带来质的飞跃。某校兴趣小组取某种钢样进行试验,请计算:
(1)取钢样(假设只含铁单质和碳单质)粉末100g,在氧气中充分燃烧,得到CO2气体4.4g,此钢样粉末中碳的质量分数为 (保留到0.1%)。
(2)分别向四份不同质量的钢样粉末中加入100g稀硫酸溶液,充分反应后,测得的实验数据如下表所示:
|
质量 | 实验1 | 实验2 | 实验3 | 实验4 |
| 钢样粉末质量 | 2.84g | 4.25g | 6.23g | 7.51g |
| 生成H2的质量 | 0.10g | 0.15g | 0.20g | 0.20g |
①计算硫酸溶液中溶质的质量 g
②求在实验3中溶液的溶质质量分数?
钢铁工业是国家工业的基础。2007年我国粗钢产量接近5亿吨,居世界前列。湛江的东海岛也将建设千万吨钢铁厂,这将给湛江的经济带来质的飞跃。某校兴趣小组取某种钢样进行试验,请计算:
(1)取钢样(假设只含铁单质和碳单质)粉末100g,在氧气中充分燃烧,得到CO2气体4.4g,此钢样粉末中碳的质量分数为 (保留到0.1%)。
(2)分别向四份不同质量的钢样粉末中加入100g稀硫酸溶液,充分反应后,测得的实验数据如下表所示:
|
质量 | 实验1 | 实验2 | 实验3 | 实验4 |
| 钢样粉末质量 | 2.84g | 4.25g | 6.23g | 7.51g |
| 生成H2的质量 | 0.10g | 0.15g | 0.20g | 0.20g |
①计算硫酸溶液中溶质的质量 g
②求在实验3中溶液的溶质质量分数?

 序数
序数