题目内容
【题目】已知某黄铜(铜锌合金)粉末共6克与100克稀硫酸恰好反应完全,过滤后得滤液101.2克。求:(结果保留1位小数)
(1)黄铜中铜的质量
(2)参加反应的硫酸的质量分数。
【答案】4.8克。1.9%。
【解析】
铜的金属活动性在(H)后,不能与稀硫酸发生反应.利用锌与稀硫酸反应的化学方程式和滤液的增量,列出比例式,就可计算出原混合物中锌的质量和稀硫酸溶液中含有硫酸(即溶质)的质量,据此分析判断进行计算。
解:设黄铜中锌的质量为x、稀硫酸中溶质的质量为y、
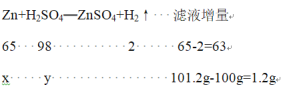
![]() =
=![]()
![]() =
= ![]()
解得:x=1.24g y=1.87g
所以,黄铜中铜的质量为6g-1.24g=4.76g≈4.8g
稀硫酸中溶质的质量分数为
![]() 1.9%
1.9%
答 :(1).黄铜中铜的质量为4.8g,(2).参加反应的硫酸的质量分数为1.9%。

练习册系列答案
 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目