��Ŀ����
����Ŀ��Ϊ̽����Ļ�ѧ���ʣ�������ͼ1ʵ�飺 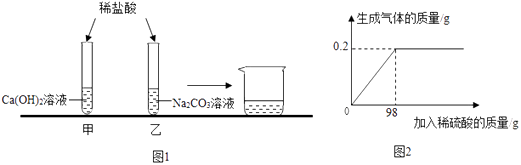
�ټ�ʵ��û�й۲쵽����������ʵ��������
�ڽ���Ӧ��������Թ��е���Һ���ֵ����ձ��У�û�й۲쵽��������
�ɴ˲��뷴Ӧ�����Թ�����Һ�����ʣ�
a��NaCl��HCl b��
��Ϊ����֤����a��ijͬѧ�����Թ���ʣ����Һ�����������ʵ�鷽����
������� | ʵ����� | ʵ������ | ���� |
����1 | ȡ�����Թ��У��μ���ɫʯ����Һ | ����a���� | |
����2 | ȡ�����Թ��У��μ���������Һ | ������ɫ���� |
����2�����������������û�ѧ����ʽ��ʾ����
���������ʴ���ʯ����Һ��Ҳ���Դﵽ��֤Ŀ�ģ����в���ȷ����������ţ���
A������ B��̼���Ʒ�ĩ C������ͭ��ĩ D����������
������������ʲⶨпͭ�������ͭ������������ȡ10g��Ʒ�����ձ��У�����һ��������ϡ���ᣮ����ϡ���������������������ϵ��ͼ2��ʾ��
�����������ʵ�����mol��
�������Ʒ��ͭ�����������������û�ѧ����ʽ���㣩
���𰸡��������ݣ�NaCl����Һ���ɫ��NaCl+AgNO3=AgCl��+NaNO3��D��0.1
���������⣺���������ƺ�ϡ���ᷴӦ�����Ȼ��ƺ�ˮ��̼���ƺ�ϡ���ᷴӦ�����Ȼ��ơ�ˮ�Ͷ�����̼�������ʵ�������Dz������ݣ� ����������ݣ��ڽ���Ӧ��������Թ��е���Һ���ֵ����ձ��У�û�й۲쵽��������˵�����е�̼�����Ѿ���ȫ��Ӧ��������Ϊ���̼���ƹ���ʱ���ܺͼ��з�Ӧ���ɵ��Ȼ��Ʒ�Ӧ����̼��ư�ɫ�������ɴ˲��뷴Ӧ�����Թ�����Һ�����ʿ�����ǡ����ȫ��Ӧ���ɵ��Ȼ��ƣ�Ҳ�����Ƿ�Ӧ���ɵ��Ȼ��ƺ������Ȼ��⣮
���NaCl������֤����a������1��ȡ�����Թ��У��μ���ɫʯ����Һ����Һ���ɫ������a������
����2��ȡ�����Թ��У��μ���������Һ��������ɫ����������a������ʵ�鷽�����±���ʾ��
������� | ʵ����� | ʵ������ | ���� |
����1 | ȡ�����Թ��У��μ���ɫʯ����Һ | ��Һ���ɫ | ����a���� |
����2 | ȡ�����Թ��У��μ���������Һ | ������ɫ���� |
����2�������������ǣ���Ӧ���ɵ��Ȼ����ܺ���������Ӧ���ɰ�ɫ�����Ȼ����������ƣ���Ӧ�Ļ�ѧ����ʽΪ��NaCl+AgNO3=AgCl��+NaNO3 ��
���NaCl+AgNO3=AgCl��+NaNO3 ��
��A����������ʱ���������ݣ�˵����Һ�к���ϡ���ᣬ��ѡ����ȷ��
B������̼���Ʒ�ĩʱ���������ݣ�˵����Һ�к���ϡ���ᣬ��ѡ����ȷ��
C����������ͭ��ĩʱ����Һ����ɫ�����ɫ��˵�� ��Һ�к���ϡ���ᣬ��ѡ����ȷ��
D��������������ʱ���������������ж���Һ���Ƿ���ϡ���ᣬ��ѡ���ȷ��
��ѡ��D���ܢ��������������ʵ����ǣ�0.2g/2gmol��=0.1mol��
���0.1��
�������Ʒ��п�����ʵ�����x��
Zn+H2SO4�TZnSO4+ | H2�� |
1 | 1 |
x | 0.1mol |
![]() =
= ![]() ��
��
x=0.1mol��
п������Ϊ��65g/mol��0.1mol=6.5g��![]() ��100%=35%��
��100%=35%��
����Ʒ��ͭ������������35%��
�����㾫����������д��ѧ����ʽ�����ֱ���ʽ�����뷽��ʽ���ݻ�ѧ��Ӧ����ʽ�ļ����ǽ����ĸ�������Ҫ֪��ע�⣺a����ƽ b������ c�����ţ������ʼ�������=ϵ������Է�������֮�ȣ�

����Ŀ��ij��ɫ������ܺ���Na2CO3��Na2SO4��NaOH��Ba��NO3��2�е�һ�ֻ��֣���������ʵ�飺����֪�Ȼ�����Һ�����ԣ� 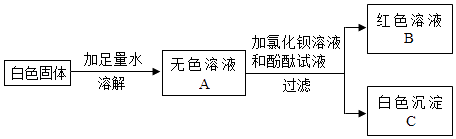
���ܽ���˶��õ������� ��
���ڰ�ɫ����C�м��� �� �����ݲ���������ȫ���ܽ⣮��������ʵ�������ԭ��ɫ������һ���� �� һ��û����
��Ϊ��һ��ȷ����ɫ�����п��ܴ��ڵ����ʣ��Ժ�ɫ��ҺB����ʵ�飬����±���
ʵ����� | ʵ������ | ��������� |
ȡ������ɫ��Һ���Թ��У����� | ԭ��ɫ�й������������� |