题目内容
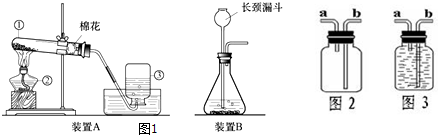
鸡蛋壳的主要成分是碳酸钙(其它成分不溶于水也不与酸反应).化学兴趣小组为了测定鸡蛋壳中碳酸钙的含量,做如下实验: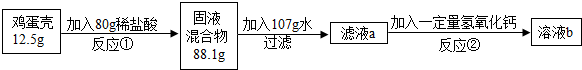
反应①结束后,所加盐酸刚好反应了一半,反应②恰好完全反应.请回答下列问题:
(1)反应①的化学方程式为 ;
(2)根据已知条件列出求解碳酸钙质量(X)的比例式 ;
(3)该鸡蛋壳中碳酸钙的质量分数为 ;
(4)所加氢氧化钙的质量为 ;
(5)溶液b中溶质的质量分数为 ;
(6)用36.5%的浓盐酸配制80g上述稀盐酸需加水的质量为 .

反应①结束后,所加盐酸刚好反应了一半,反应②恰好完全反应.请回答下列问题:
(1)反应①的化学方程式为
(2)根据已知条件列出求解碳酸钙质量(X)的比例式
(3)该鸡蛋壳中碳酸钙的质量分数为
(4)所加氢氧化钙的质量为
(5)溶液b中溶质的质量分数为
(6)用36.5%的浓盐酸配制80g上述稀盐酸需加水的质量为
考点:根据化学反应方程式的计算,用水稀释改变浓度的方法,有关溶质质量分数的简单计算
专题:综合计算(图像型、表格型、情景型计算题)
分析:(1)碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳;
(2)反应前后的质量差即为生成二氧化碳的质量,根据二氧化碳的质量可以计算碳酸钙的质量;
(3)根据碳酸钙的质量可以计算该鸡蛋壳中碳酸钙的质量分数;
(4)根据氯化氢的质量可以计算氢氧化钙的质量;
根据氯化钙的质量、溶液的质量可以计算溶液b中溶质的质量分数;
(6)溶液稀释前后,溶质质量不变.
(2)反应前后的质量差即为生成二氧化碳的质量,根据二氧化碳的质量可以计算碳酸钙的质量;
(3)根据碳酸钙的质量可以计算该鸡蛋壳中碳酸钙的质量分数;
(4)根据氯化氢的质量可以计算氢氧化钙的质量;
根据氯化钙的质量、溶液的质量可以计算溶液b中溶质的质量分数;
(6)溶液稀释前后,溶质质量不变.
解答:解:(1)反应①的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑.
故填:CaCO3+2HCl═CaCl2+H2O+CO2↑.
(2)设碳酸钙的质量为x,反应的氯化氢的质量为y,生成氯化钙的质量为z,
反应生成二氧化碳的质量为:12.5g+80g-88.1g=4.4g,
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 73 111 44
x y z 4.4g
=
=
=
,
x=10g,y=7.3g,z=11.1g,
故填:
=
,
(3)该鸡蛋壳中碳酸钙的质量分数为:
×100%=80%,
故填:80%.
(4)设所加氢氧化钙的质量为m,生成氯化钙的质量为n,由于反应①结束后,所加盐酸刚好反应了一半,反应②恰好完全反应,则反应②消耗的盐酸也是7.3g,
Ca(OH)2+2HCl═CaCl2+2H2O,
74 73 111
m 7.3g n
=
=
,
m=7.4g,n=11.1g,
故填:7.4g.
(5)溶液b的质量为:10g+80g+107g+7.4g-4.4g=200g,
溶液b中溶质的质量分数为:
×100%=11.1%,
故填:11.1%.
(6)设需要36.5%的浓盐酸的质量为w,
则w×36.5%=7.3g+7.3g,
w=40g,
用36.5%的浓盐酸配制80g上述稀盐酸需加水的质量为:80g-40g=40g,
故填:40g.
故填:CaCO3+2HCl═CaCl2+H2O+CO2↑.
(2)设碳酸钙的质量为x,反应的氯化氢的质量为y,生成氯化钙的质量为z,
反应生成二氧化碳的质量为:12.5g+80g-88.1g=4.4g,
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 73 111 44
x y z 4.4g
| 100 |
| x |
| 73 |
| y |
| 111 |
| z |
| 44 |
| 4.4g |
x=10g,y=7.3g,z=11.1g,
故填:
| 100 |
| x |
| 44 |
| 4.4g |
(3)该鸡蛋壳中碳酸钙的质量分数为:
| 10g |
| 12.5g |
故填:80%.
(4)设所加氢氧化钙的质量为m,生成氯化钙的质量为n,由于反应①结束后,所加盐酸刚好反应了一半,反应②恰好完全反应,则反应②消耗的盐酸也是7.3g,
Ca(OH)2+2HCl═CaCl2+2H2O,
74 73 111
m 7.3g n
| 74 |
| m |
| 73 |
| 7.3g |
| 111 |
| n |
m=7.4g,n=11.1g,
故填:7.4g.
(5)溶液b的质量为:10g+80g+107g+7.4g-4.4g=200g,
溶液b中溶质的质量分数为:
| 11.1g+11.1g |
| 200g |
故填:11.1%.
(6)设需要36.5%的浓盐酸的质量为w,
则w×36.5%=7.3g+7.3g,
w=40g,
用36.5%的浓盐酸配制80g上述稀盐酸需加水的质量为:80g-40g=40g,
故填:40g.
点评:本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
下列图象中有关量的变化趋势与对应叙述关系正确的是( )
A、 向一定质量表面生锈的铁片中滴加盐酸至过量 |
B、 向一定质量的稀硫酸中滴加水 |
C、 向盐酸和氯化铁的混合溶液中滴加氢氧化钠溶液至过量 |
D、 高温煅烧一定质量的石灰石 |
 生活离不开水,净化水的知识在日常生活中有着广泛的应用
生活离不开水,净化水的知识在日常生活中有着广泛的应用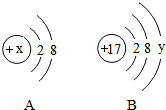 如图中A、B分别是某微粒的结构示意图,回答下列问题:
如图中A、B分别是某微粒的结构示意图,回答下列问题: