题目内容
【题目】实验小组设计了分离NaCl和CaCl2两种固体的实验方案,据此回答问题: 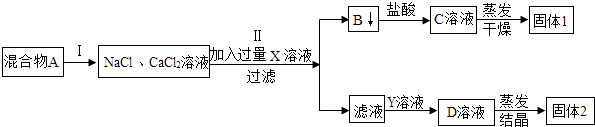
(1)写出试剂X的化学式;
(2)加入过量X溶液,过滤后所得滤液中含有的溶质是(化学式),在滤液中加入适量Y后,蒸发即可得到较纯净的NaCl固体,写出有关的化学方程式 .
【答案】
(1)Na2CO3
(2)NaCl、Na2CO3;Na2CO3+2HCl=2NaCl+H2O+CO2↑
【解析】解:(1)NaCl和CaCl2两种固体混合物,溶解后加入过量碳酸钠溶液,生成碳酸钙沉淀和氯化钠,过滤后得到的沉淀B为碳酸钙,碳酸钙和盐酸反应生成氯化钙溶液,经蒸发可得到氯化钙固体,所以试剂X为碳酸钠溶液;故填:Na2CO3;(2)由于碳酸钠过量,所以滤液中的物质有氯化钠和碳酸钠,因此要得到纯净的氯化钠就需要除去碳酸钠,向滤液中加入适量盐酸至不产生气体,生成氯化钠和水和二氧化碳,蒸发后最后的固体物质是氯化钠,化学方程式Na2CO3+2HCl=2NaCl+H2O+CO2↑.
所以答案是:NaCl、Na2CO3;Na2CO3+2HCl=2NaCl+H2O+CO2↑.
【考点精析】根据题目的已知条件,利用混合物的分离方法和书写化学方程式、文字表达式、电离方程式的相关知识可以得到问题的答案,需要掌握混合物的分离:1、过滤法:分离可溶物 + 难溶物2、结晶法:分离几种可溶性物质;注意:a、配平 b、条件 c、箭号.

练习册系列答案
相关题目