题目内容
 小刚为了解生活中常见的锌锰干电池,做了以下探究:他打开一节废电池,观察到如下现象:①黑色碳棒完好无损;②电极周围充满黑色粉末;③里面有少量无色晶体;④金属外壳明显破损.
小刚为了解生活中常见的锌锰干电池,做了以下探究:他打开一节废电池,观察到如下现象:①黑色碳棒完好无损;②电极周围充满黑色粉末;③里面有少量无色晶体;④金属外壳明显破损.
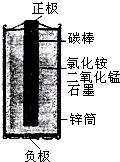
小刚查阅了资料:锌锰干电池的结果如图所示,它以中心的碳棒(石墨)做正极,外围的锌筒做负极,锌筒与碳棒之间填满用氯化铵溶液(做电解质)拌湿的二氧化锰和石墨,石墨不参加化学反应,仅起导电作用,在电池的使用中,锌逐渐变成了氯化锌.请你根据初中学习的知识和小刚的探究活动,填写以下空白.
(1)用碳棒做电极主要利用了石墨的________性.
(2)干电池在使用过程中的能量转化是________.
(3)以氯化锌为例,写出证明废电池中含有氯化物的化学方程式________.
(4)通过回收废旧锌锰电池可得到的物质有________(至少答2种).
解:(1)碳棒的主要成分是石墨,石墨导电性良好.故填:导电性.
(2)干电池在使用过程中的能量转化是化学能转化为电能.故填:化学能转化为电能.
(3)如果向酸化的硝酸银中加入某种物质生成了白色沉淀,说明加入的物质是氯化物.证明废电池中含有氯化物的化学方程式为:ZnCl2+2AgNO3=2AgCl↓+Zn(NO3)2.
故填:ZnCl2+2AgNO3=2AgCl↓+Zn(NO3)2.
(4)可得到的物质有石墨、二氧化锰等.故填:石墨、二氧化锰.
分析:根据反应物和生成物及其质量守恒定律可以书写化学方程式,根据反应过程可以判断能量的变化情况.
点评:解答本题的关键是要充分理解化学反应的实质,只有这样才能对问题做出正确的判断.
(2)干电池在使用过程中的能量转化是化学能转化为电能.故填:化学能转化为电能.
(3)如果向酸化的硝酸银中加入某种物质生成了白色沉淀,说明加入的物质是氯化物.证明废电池中含有氯化物的化学方程式为:ZnCl2+2AgNO3=2AgCl↓+Zn(NO3)2.
故填:ZnCl2+2AgNO3=2AgCl↓+Zn(NO3)2.
(4)可得到的物质有石墨、二氧化锰等.故填:石墨、二氧化锰.
分析:根据反应物和生成物及其质量守恒定律可以书写化学方程式,根据反应过程可以判断能量的变化情况.
点评:解答本题的关键是要充分理解化学反应的实质,只有这样才能对问题做出正确的判断.

练习册系列答案
相关题目
 29、小刚为了解生活中常见的锌锰干电池,做了以下探究:他打开一节废电池,观察到如下现象:①黑色碳棒完好无损;②电极周围充满黑色粉末;③里面有少量无色晶体;④金属外壳明显破损.
29、小刚为了解生活中常见的锌锰干电池,做了以下探究:他打开一节废电池,观察到如下现象:①黑色碳棒完好无损;②电极周围充满黑色粉末;③里面有少量无色晶体;④金属外壳明显破损. 15、小刚为了解生活中常见的锌锰干电池,做了以下探究:他打
15、小刚为了解生活中常见的锌锰干电池,做了以下探究:他打
