题目内容
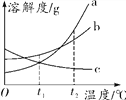
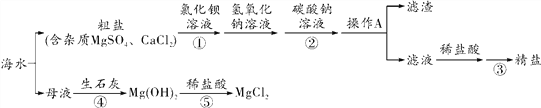
【题目】有A、B两种金属分别放入相同浓度的稀硫酸中,生成氢气的质量与反应时间的关系如图所示,下列结论不合理的是 ( )
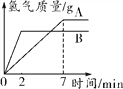
A. 金属活动性B>A
B. 反应消耗硫酸的质量一定不相等
C. 0~2 min,B产生氢气的质量较多
D. 0~7 min,参加反应的A、B的质量相等
【答案】D
【解析】A、根据图示,相同时间内B放出氢气的质量大于A,可判断金属活动性顺序是B>A,合理;B、金属与酸的反应生成氢气时,氢气中氢元素全部来源于酸,所以生成的氢气与消耗的酸的多少顺序一致,图示中产生的氢气质量不相等,反应消耗硫酸的质量一定不相等,合理;C、根据图示0~2 min,B产生氢气的质量较多,合理;D、金属的相对原子质量和化合价不确定,所以不能确定参加反应的金属的质量,不合理。故选D。

【题目】兴趣小组在做完盐的性质实验后,发现一瓶碳酸钠固体可能混入了氯化钠、硫酸钠中的一种或两种。为此,他们对这瓶固体的成分进行了探究。
【实验验证】
实验步骤 | 现象 | 结论、分析及化学方程式 |
(1)取少量该样品于烧杯中,加入适量的水,溶解,得到溶液A。 | ||
(2)取少量溶液A于试管中,滴入过量的稀硝酸,再滴入过量的硝酸钡溶液,充分反应后,静置。 | ______。 | 说明该固体中混有硫酸钠。写出证明有硫酸钠存在的化学方程式:______________。 |
(3)取步骤(2)中的上层清液于试管中,滴入几滴硝酸银溶液。 | 有白色沉淀生成。 | 说明该固体中________。实验结束所得溶液中一定含有的阳离子是________。 |
【实验反思】步骤(2)中滴入过量稀硝酸的目的是______________________。
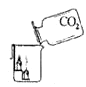
【实验拓展】兴趣小组还想测定该固体中碳酸钠的质量分数,利用如图所示的实验装置(气密性良好)进行实验,每一步反应均完全进行。
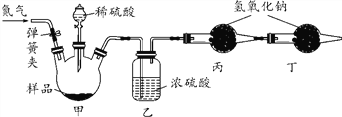
(1)为达到实验目的,首先称取一定质量的该固体样品放入装置甲中,然后进行有关实验操作,正确的顺序是________(填序号,可重复)。
a. 称量装置丙。
b. 打开弹簧夹,通入足量的氮气,关闭弹簧夹。
c. 打开分液漏斗的活塞,注入足量的稀硫酸,关闭活塞。
(2)装置乙的作用是________________________。