题目内容
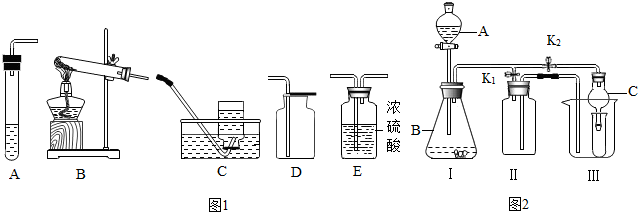
图1甲图是利用一氧化碳与氧化铁反应装置示意图,图1乙是高炉炼铁示意图.请回答下列问题:(A处为澄清石灰水)
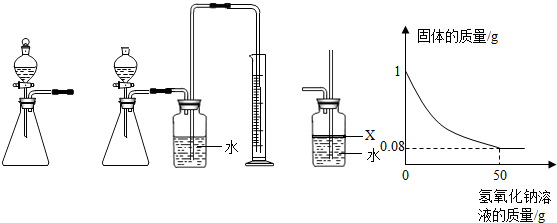
(1)甲图实验过程中,先要进行的是______(填Ⅰ或Ⅱ).Ⅰ:加热Ⅱ:通入CO
(2)甲图中硬质玻璃管里发生反应的现象是______,观察到A处出现的现象是______,其中发生的化学反应方程式是______ 2Fe+3CO2;CO2+Ca(OH)2=CaCO3↓+H2
(2)根据一氧化碳与三氧化二铁的反应原理、现象分析即可;
(3)根据CO有毒的性质分析即可;
(4)根据焦炭的反应分析作用;
(5)结合生铁与炉渣的密度分析即可;
(6)①根据实验的目的和空气的成分分析;
②根据压强的变化分析;
(7)根据氧化铁的质量求出纯铁的质量,再换算出生铁的质量.
解答:解:(1)为了赶净装置中的空气,应该先通一氧化碳再点燃酒精喷灯,若在实验前未赶装置中的空气,容易发生爆炸;故答案为:Ⅱ;
(2)一氧化碳还原氧化铁的同时生成铁和二氧化碳,所以在硬质玻璃管里发生反应的现象是:红色固体变成黑色;观察到A处出现的现象是:澄清石灰水变浑浊;其中发生的化学反应方程式是:Fe2O3+3CO
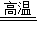 2Fe+3CO2;CO2+Ca(OH)2=CaCO3↓+H20;故答案为:红色固体变成黑色;石灰水变浑浊;Fe2O3+3CO
2Fe+3CO2;CO2+Ca(OH)2=CaCO3↓+H20;故答案为:红色固体变成黑色;石灰水变浑浊;Fe2O3+3CO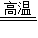 2Fe+3CO2;CO2+Ca(OH)2=CaCO3↓+H20;
2Fe+3CO2;CO2+Ca(OH)2=CaCO3↓+H20;(3)因为一氧化碳有毒,不能直接排到大气中,可以用点燃的方法除去一氧化碳,所以甲图中实验要在装置末端a处燃着一盏酒精灯,其作用是:点燃一氧化碳,防止污染空气;其中发生的化学反应方程式是:2CO+O2
 2CO2;故答案为:点燃一氧化碳,防止污染空气;2CO+O2
2CO2;故答案为:点燃一氧化碳,防止污染空气;2CO+O2 2CO2;
2CO2;(4)炼铁要用到焦炭,它有两个作用,炼铁需要高温,一方面焦炭在燃烧的过程中能放出大量的热,另一方面炼铁还需要一氧化碳,焦炭又可以把刚生成的二氧化碳还原为一氧化碳;故答案为:①提供热量、产生高温;②生成还原剂CO;
(5)因为生铁密度大于炉渣密度,所以乙图中出铁口低于炉渣出口;故答案为:因为生铁密度大于炉渣密度;
(6)①利用氢氧化钠溶液可以吸收二氧化碳气体,增重的质量就是二氧化碳的质量,为排除空气中二氧化碳的干扰,所以通入干燥氮气,故答案为:排净空气,防止干扰实验的测定;
②停止加热前不需要先断开a和b的连接处以防止倒吸,因为实验中要持续通入氮气;故答案为:不需要,因为实验中要持续通入氮气;
(7)设理论上可以炼出含铁96%的生铁的质量为x.
Fe2O3+3CO
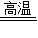 2Fe+3CO2
2Fe+3CO2160 112
1000t×80% 96%x
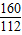 =
=
x=583.3t
答:理论上可以炼出含铁96%的生铁的质量为583.3t.
点评:本题主要考查了一氧化碳还原氧化铁及计算、其高炉炼铁等方面的内容;实验室中用一氧化碳还原氧化铁制铁的过程中,一定要注意实验操作的先后顺序,注意实验前先通一氧化碳再点燃酒精喷灯,实验结束后先熄灭酒精喷灯再停止通一氧化碳;考查含杂质物质的化学方程式的计算,注意代入方程式计算的必须是纯物质的质量是正确解答此类题的关键.

 寒假天地重庆出版社系列答案
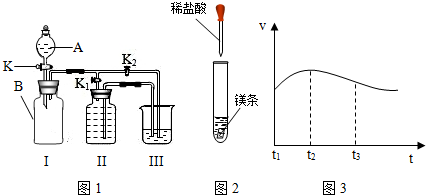
寒假天地重庆出版社系列答案在小组活动中,王老师演示了一个实验:将烘干的碳酸镁与锌粉按照一定比例研细混匀,按照图1进行实验。然后指导同学们对碳酸镁与锌粉发生的反应进行了实验探究。
【查阅资料】部分含有镁、锌元素物质的相关性质。
①氧化镁、氧化锌:均为白色固体,均与盐酸反应,生成无色盐溶液。
②碳酸镁、碳酸锌:均为白色固体,均与盐酸反应,生成无色盐溶液和二氧化碳气体。
【实验探究】
(1)实验一:碳酸镁与锌粉反应的气体产物是什么?
| 序号 | 实验操作 | 实验现象 |
| ① | 收集两瓶气体,盖好玻璃片。向其中一瓶迅速倒入少量澄清石灰水,盖好振荡。 | 无明显现象。 |
| ② | 将另一瓶气体点燃,待火焰熄灭后,迅速倒入少量澄清石灰水,盖好振荡。 | 气体安静燃烧,火焰呈蓝色,澄清石灰水变浑浊。 |
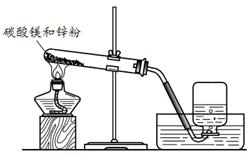
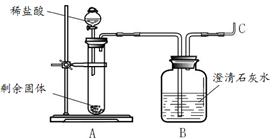
图1 图2
(2)实验二:碳酸镁与锌粉反应的固体产物是什么?
王老师将剩余固体分成2份,由甲、乙两组同学进行探究。
甲组同学将剩余固体直接按照图2进行实验,观察到A中有大量气泡生成,B中的澄清石灰水变浑浊,将产生的气体在C处验纯后点燃,观察到淡蓝色火焰。C处点燃的气体是 (填化学式)。甲组同学获得结论:该反应的固体产物是碳酸锌和镁。
乙组同学将剩余固体先进行了处理,然后也按照图2进行了实验,观察到A中固体溶解,生成无色溶液,B中没有明显变化。他们对剩余固体的处理操作是 。乙组同学利用质量守恒定律和实验现象,分析碳酸镁与锌粉发生反应后的固体产物是氧化锌和氧化镁,其理由是 。
(3)实验反思:老师看到两组同学的实验报告后,确定乙组的结论是正确的,碳酸镁与锌粉反应的化学方程式为 。同学们对甲组的实验过程再次进行了分析,由B、C处产生的现象,可以说明甲组放入试管A中的固体成分含有 。
在小组活动中,王老师演示了一个实验:将烘干的碳酸镁与锌粉按照一定比例研细混匀,按照图1进行实验。然后指导同学们对碳酸镁与锌粉发生的反应进行了实验探究。
【查阅资料】部分含有镁、锌元素物质的相关性质。
①氧化镁、氧化锌:均为白色固体,均与盐酸反应,生成无色盐溶液。
②碳酸镁、碳酸锌:均为白色固体,均与盐酸反应,生成无色盐溶液和二氧化碳气体。
【实验探究】
(1)实验一:碳酸镁与锌粉反应的气体产物是什么?
|
序号 |
实验操作 |
实验现象 |
|
① |
收集两瓶气体,盖好玻璃片。向其中一瓶迅速倒入少量澄清石灰水,盖好振荡。 |
无明显现象。 |
|
② |
将另一瓶气体点燃,待火焰熄灭后,迅速倒入少量澄清石灰水,盖好振荡。 |
气体安静燃烧,火焰呈蓝色,澄清石灰水变浑浊。 |
结论:碳酸镁与锌粉反应的气体产物是 。②中气体燃烧的化学方程式为 。
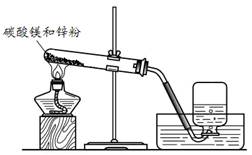
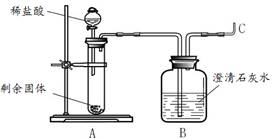
图1 图2
(2)实验二:碳酸镁与锌粉反应的固体产物是什么?
王老师将剩余固体分成2份,由甲、乙两组同学进行探究。
甲组同学将剩余固体直接按照图2进行实验,观察到A中有大量气泡生成,B中的澄清石灰水变浑浊,将产生的气体在C处验纯后点燃,观察到淡蓝色火焰。C处点燃的气体是 (填化学式)。甲组同学获得结论:该反应的固体产物是碳酸锌和镁。
乙组同学将剩余固体先进行了处理,然后也按照图2进行了实验,观察到A中固体溶解,生成无色溶液,B中没有明显变化。他们对剩余固体的处理操作是 。乙组同学利用质量守恒定律和实验现象,分析碳酸镁与锌粉发生反应后的固体产物是氧化锌和氧化镁,其理由是 。
(3)实验反思:老师看到两组同学的实验报告后,确定乙组的结论是正确的,碳酸镁与锌粉反应的化学方程式为 。同学们对甲组的实验过程再次进行了分析,由B、C处产生的现象,可以说明甲组放入试管A中的固体成分含有 。