题目内容
在实验室中阳阳同学按照下图的装置完成金属与盐酸反应的比较实验,实验后装置中发现只有一种紫红色金属。请回答:

(1)下图是回收该金属的实验操作:
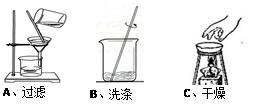
操作中有一处错误,指出错误 。
(2)经过上(1)中的A操作之后,得到的滤液中一定含有的阳离子是 ,写出实验过程中铁与盐酸发生反应的化学方程式 。

(1)下图是回收该金属的实验操作:

操作中有一处错误,指出错误 。
(2)经过上(1)中的A操作之后,得到的滤液中一定含有的阳离子是 ,写出实验过程中铁与盐酸发生反应的化学方程式 。
(1)用手拿蒸发皿。
(2)亚铁离子、锌离子、镁离子,Fe+2HCl ="=" FeC12 + H2↑。
(2)亚铁离子、锌离子、镁离子,Fe+2HCl ="=" FeC12 + H2↑。
:(1)在进行干燥操作中,干燥完毕应使用坩埚钳取下加热后蒸发皿而不能用手直接取下;
(2)根据金属活动性强弱关系镁>锌>铁>氢>铜,镁、锌、铁可与盐酸反应,镁与盐酸反应生成氯化镁、锌与盐酸反应生成氯化锌、铁与盐酸反应生成氯化亚铁,因此反应后所得溶液中一定含有的离子有镁离子、锌离子和亚铁离子;铁与盐酸反应的化学方程式为Fe+2HCl═FeCl2+H2↑;
故答案为:(1)用手拿蒸发皿;
(2)亚铁离子,锌离子,镁离子;Fe+2HCl═FeCl2+H2↑.
(2)根据金属活动性强弱关系镁>锌>铁>氢>铜,镁、锌、铁可与盐酸反应,镁与盐酸反应生成氯化镁、锌与盐酸反应生成氯化锌、铁与盐酸反应生成氯化亚铁,因此反应后所得溶液中一定含有的离子有镁离子、锌离子和亚铁离子;铁与盐酸反应的化学方程式为Fe+2HCl═FeCl2+H2↑;
故答案为:(1)用手拿蒸发皿;
(2)亚铁离子,锌离子,镁离子;Fe+2HCl═FeCl2+H2↑.

练习册系列答案
相关题目