题目内容
金属是一种非常重要的资源,在生产、生活中有着广泛的用途.(1)人类每年从自然界提取大量的金属,其中提取量最大的是铁.用赤铁矿(主要成分为Fe2O3)和一氧化碳炼铁的化学方程式为 ______ 2Fe+3CO2
【答案】分析:由于铁的化学性质比较活泼,因此在自然界中铁元素主要存在于化合物中,金属铁容易在潮湿的空气中生锈;金属和酸反应时,只有在金属活动性顺序表中氢前的金属可以置换出酸中的氢离子,而且越靠前的金属反应越剧烈;金属和盐反应时,在金属活动性顺序表中只有前面的金属可以把它后面的金属从盐溶液中置换出来,钾、钙、钠除外.
解答:解:(1)一氧化碳具有还原性,在高温条件下,可以把氧化铁中的铁还原出来,故答案为:3CO+Fe2O3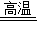 2Fe+3CO2
2Fe+3CO2
(2)钢铁生锈是铁与空气中的水、氧气共同作用的结果,除锈可以用稀硫酸或稀盐酸,故答案为:水、氧气,用适量的稀硫酸浸泡至铁锈消失,然后再用水冲洗干净,干燥后涂上些油从而防锈.
Fe2O3+H2SO4=Fe2(SO4)3+3H2O
(3)由于镁和铁都在氢前,都能和稀盐酸反应,而且反应剧烈的是镁,而铜和银都不能和盐酸反应,为证明两金属的金属活动性强弱,可选用硝酸银溶液或硫酸铜溶液,故答案为:①硝酸银溶液(或硫酸铜溶液)
②冒出气泡的速率快③铜丝表面有一层银白色物质生成(或无明显现象)
(4)由于合金中只有金属锌可以和稀盐酸反应,根据氢气的质量就可求出其他物质的量.
故答案为:
解:生成氢气的质量为:10g+100g-109.8g=0.2g
设黄铜中锌的质量为x,稀盐酸中溶质的质量为y.
Zn+2HCl=ZnCl2+H2↑
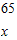

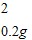
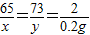
x=6.5g,y=7.3g
黄铜中铜的质量分数为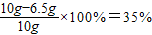
需要36.5%的浓盐酸质量为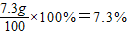
答:黄铜中铜的质量分数35%,所用的稀盐酸质量分数为7.3%.
点评:该题难度适中,主要考查了对金属活动性顺序的灵活运用,及根据化学方程式进行有关的计算,培养学生应用知识的能力.
解答:解:(1)一氧化碳具有还原性,在高温条件下,可以把氧化铁中的铁还原出来,故答案为:3CO+Fe2O3
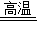 2Fe+3CO2
2Fe+3CO2(2)钢铁生锈是铁与空气中的水、氧气共同作用的结果,除锈可以用稀硫酸或稀盐酸,故答案为:水、氧气,用适量的稀硫酸浸泡至铁锈消失,然后再用水冲洗干净,干燥后涂上些油从而防锈.
Fe2O3+H2SO4=Fe2(SO4)3+3H2O
(3)由于镁和铁都在氢前,都能和稀盐酸反应,而且反应剧烈的是镁,而铜和银都不能和盐酸反应,为证明两金属的金属活动性强弱,可选用硝酸银溶液或硫酸铜溶液,故答案为:①硝酸银溶液(或硫酸铜溶液)
②冒出气泡的速率快③铜丝表面有一层银白色物质生成(或无明显现象)
(4)由于合金中只有金属锌可以和稀盐酸反应,根据氢气的质量就可求出其他物质的量.
故答案为:
解:生成氢气的质量为:10g+100g-109.8g=0.2g
设黄铜中锌的质量为x,稀盐酸中溶质的质量为y.
Zn+2HCl=ZnCl2+H2↑
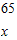

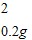
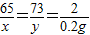
x=6.5g,y=7.3g
黄铜中铜的质量分数为
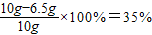
需要36.5%的浓盐酸质量为
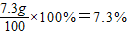
答:黄铜中铜的质量分数35%,所用的稀盐酸质量分数为7.3%.
点评:该题难度适中,主要考查了对金属活动性顺序的灵活运用,及根据化学方程式进行有关的计算,培养学生应用知识的能力.

练习册系列答案
相关题目