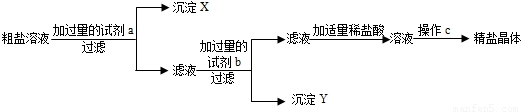
题目内容
(2005?山西)小军在一次实验中,将带有铁锈的铁片放入一定量的稀硫酸中,细心观察,发现下列现象:①铁锈逐渐消失,溶液变为橙黄色;②铁片表面有气泡产生,溶液由橙黄色逐渐变为浅绿色.回答:(1)写出现象①的反应化学方程式______;
(2)写出现象②中产生气泡的反应化学方程式______;
(3)为弄清溶液由橙黄色变为浅绿色的原因,请你帮助小军设计出探究方案(简略写出实验内容)
【答案】分析:(1)已知将带有铁锈的铁片放入一定量的稀硫酸中,而铁锈的主要成分为氧化铁;“铁锈逐渐消失,溶液变为橙黄色”,则为氧化铁与硫酸反应;
(2)铁片表面有气泡产生,则铁与硫酸反应,可以书写化学方程式;
(3)弄清溶液由橙黄色变为浅绿色的原因,设计方案:因为“铁片表面有气泡产生,溶液由橙黄色逐渐变为浅绿色”,则需要验证是氢气,还是铁,使橙黄色硫酸铁变浅绿色.
解答:解:(1);“铁锈逐渐消失,溶液变为橙黄色”,因为铁锈的主要成分氧化铁与硫酸反应,则此反应的化学方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(2)铁片表面有气泡产生,则铁与硫酸反应,可以书写化学方程式为Fe+H2SO4=FeSO4+H2↑;
(3)为弄清溶液由橙黄色变为浅绿色的原因,设计探究方案为:配制Fe2(SO4)3(或FeCl3)溶液,并取该溶液少许分别注入两支试管中,其一加入过量铁粉,振荡,观察橙黄色溶液是否变浅绿色;另一试管中通足量氢气,观察橙黄色溶液是否变浅绿色.
故答为:(1)Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;(2)Fe+H2SO4=FeSO4+H2↑
(3)配制Fe2(SO4)3(或FeCl3)溶液,并取该溶液少许分别注入两支试管中,其一加入过量铁粉,振荡,观察橙黄色溶液是否变浅绿色;另一试管中通足量氢气,观察橙黄色溶液是否变浅绿色.
点评:回顾酸、金属的化学性质及其应用;了解铁锈的主要成分为氧化铁;培养根据题意,找出反应物和生成物,正确书写化学方程式的能力.
(2)铁片表面有气泡产生,则铁与硫酸反应,可以书写化学方程式;
(3)弄清溶液由橙黄色变为浅绿色的原因,设计方案:因为“铁片表面有气泡产生,溶液由橙黄色逐渐变为浅绿色”,则需要验证是氢气,还是铁,使橙黄色硫酸铁变浅绿色.
解答:解:(1);“铁锈逐渐消失,溶液变为橙黄色”,因为铁锈的主要成分氧化铁与硫酸反应,则此反应的化学方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(2)铁片表面有气泡产生,则铁与硫酸反应,可以书写化学方程式为Fe+H2SO4=FeSO4+H2↑;
(3)为弄清溶液由橙黄色变为浅绿色的原因,设计探究方案为:配制Fe2(SO4)3(或FeCl3)溶液,并取该溶液少许分别注入两支试管中,其一加入过量铁粉,振荡,观察橙黄色溶液是否变浅绿色;另一试管中通足量氢气,观察橙黄色溶液是否变浅绿色.
故答为:(1)Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;(2)Fe+H2SO4=FeSO4+H2↑
(3)配制Fe2(SO4)3(或FeCl3)溶液,并取该溶液少许分别注入两支试管中,其一加入过量铁粉,振荡,观察橙黄色溶液是否变浅绿色;另一试管中通足量氢气,观察橙黄色溶液是否变浅绿色.
点评:回顾酸、金属的化学性质及其应用;了解铁锈的主要成分为氧化铁;培养根据题意,找出反应物和生成物,正确书写化学方程式的能力.

练习册系列答案
 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案
相关题目
 2003年5月13日,安徽芦陵煤矿发生瓦斯爆炸.为煤矿业敲响了警钟.然而,在接下来的8天内,辽阳、山西、云南又相继发生矿难,130多鲜活的生命随之灰飞烟灭.
2003年5月13日,安徽芦陵煤矿发生瓦斯爆炸.为煤矿业敲响了警钟.然而,在接下来的8天内,辽阳、山西、云南又相继发生矿难,130多鲜活的生命随之灰飞烟灭. 2003年5月13日,安徽芦陵煤矿发生瓦斯爆炸.为煤矿业敲响了警钟.然而,在接下来的8天内,辽阳、山西、云南又相继发生矿难,130多鲜活的生命随之灰飞烟灭.
2003年5月13日,安徽芦陵煤矿发生瓦斯爆炸.为煤矿业敲响了警钟.然而,在接下来的8天内,辽阳、山西、云南又相继发生矿难,130多鲜活的生命随之灰飞烟灭.