题目内容
【题目】(1)某同学用市售浓盐酸(溶质质量分数为37%,密度为1.18gmL-1)配制800g溶质质量分数为10%的稀盐酸。通过计算可知需要浓盐酸_____mL,水(密度为1gmL-1)_____mL。(上述两空答案都精确到0.1mL)
(2)某兴趣小组对石灰石样品进行如下实验取13g样品放入烧杯中,将80g稀盐酸分4记录如下。
次数 | 1 | 2 | 3 | 4 |
加入稀盐酸的质量/g | 20 | 20 | 20 | 20 |
剩余固体的质量/g | 10 | 7 | 4 | 3 |
请计算:①样品中碳酸钙的质量_____。
②最终所得溶液中氯化钙的质量分数。_____(写出计算过程,最终结果保留0.1%)。
【答案】183.2 583.8 10g 13.0%
【解析】
(1)用市售浓盐酸(溶质质量分数为37%,密度为1.18gmL-1)配制800g溶质质量分数为10%的稀盐酸;所需要的浓盐酸的质量为800g×10%÷37%≈216.2g,折合体积为216.2g÷1.18gmL-1≈183.2mL,需要的水的质量为800g-216.2g=583.8g折合体积为583.8mL;
(2)①根据前三次都是固体减少3g,而第四次只减少1g,说明此时已经完全无反应,说明剩余的固体为杂质,碳酸钙的质量为13g-3g=10g;
②设生成的氯化钙的质量为x,生成的二氧化碳的质量为y,
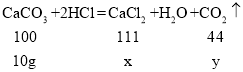
![]() x=11.1g,
x=11.1g,
![]() y=4.4g,
y=4.4g,
最终所得溶液中氯化钙的质量分数=![]() ×100%≈13.0%。
×100%≈13.0%。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目