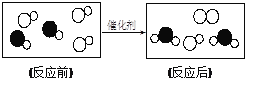题目内容
【题目】氢氧化钠和氢氧化钙是两种常见的碱。李红同学将两种碱的溶液分别装人试管A、B中,并进行了如下图所示的三组实验。

(1)实验l中,两支试管的溶液都变成_____色;
(2)实验2中,若B盛装的是NaOH溶液,该反应的现象是_____,发生反应的化学方程式为_____;
(3)实验3中,李红同学向两支试管吹气,A中有白色沉淀生成,发生反应的化学方程式为_____。B中无现象,为了探究吹气后B中溶质的成分,李红进行了如下探究。
(提出猜想):
猜想1:溶质只有氢氧化钠;
猜想2:溶质只有碳酸钠;
猜想3:溶质有_____。
(实验和结论):
实验 | 实验现象 | 结论 |
取B中少量溶液,加人澄清石灰水至不再 产生沉淀为止,过滤后取上层清液, 向其中加几滴酚酞试液。 | 产生白色沉淀 和_____ | 猜想3成立 |
(反思与评价):
老师评价李红得出的结论不正确,是因为猜想_____(填数字)也会产生相同的现象。如果要验证“猜想3成立”,必须要换试剂,将澄清石灰水换成_____溶液。
【答案】红 有蓝色沉淀生成 2NaOH+CuSO4=Cu(OH)2↓+Na2SO4 CO2+Ca(OH)2=CaCO3↓+H2O 氢氧化钠和碳酸钠 溶液变红色 2 CaCl2或Ca(NO3)2
【解析】
(1)氢氧化钠和氢氧化钙的水溶液都是碱性的,无色酚酞溶液加入以后,两种试管中的溶液都变红色;
(2)B中装的是氢氧化钠溶液,滴入硫酸铜溶液后,氢氧化钠和硫酸铜溶液反应后,有蓝色沉淀生成,方程式为:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4;
(3)人体呼出的气体中含有二氧化碳,二氧化碳和氢氧化钙反应生成碳酸钙白色沉淀和水,方程式为:CO2+Ca(OH)2=CaCO3↓+H2O;
[提出猜想]根据二氧化碳和氢氧化钠反应生成碳酸钠和水,恰好完全反应时溶质是碳酸钠,没有反应时溶质是氢氧化钠,部分反应时,溶质是氢氧化钠和碳酸钠;
[实验和结论]根据题意猜想3成立,则溶液中含有氢氧化钠和碳酸钠,碳酸钠和氢氧化钙反应生成碳酸钙和氢氧化钠,沉淀后,溶液是碱性的,无色酚酞遇碱变红色;
[反思与评价]猜想3是不正确的,设计的实验只能证明溶质中含有碳酸钠,而碳酸钠和氢氧化钙反应也是生成了碱,溶液变红不能说明原溶液中存在氢氧化钠;要检验猜想三在验证碳酸钠并且除去碳酸钠时要加中性的可溶性钙盐,如氯化钙溶液和硝酸钙溶液。

【题目】如图所示,将液体X加入到集气瓶中与固体Y作用,观察到气球逐渐变大,如表中液体X和固体Y的组合,符合题意的是( )
① | ② | ③ | ④ | ⑤ | |
X | 稀盐酸 | 水 | 水 | 双氧水 | 水 |
Y | 铁粉 | 氢氧化钠 | 氯化钠 | 二氧化锰 | 硝酸铵 |
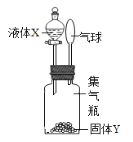
A. ①②⑤ B. ①③④ C. ①②④ D. ②③⑤