题目内容
(3分) 化学兴趣小组对生铁样品中铁的质量分数进行探究。
【查阅资料】生铁中除铁外,还含有碳、硅、磷和硫等元素。碳在生铁中以两种形式存在:一种是单质碳(C),另一种是化合碳(如Fe3C);硅、磷、硫存在形式较为复杂;这些物质通常都不与稀硫酸发生化学反应。
【实验数据】
|
|
烧杯 |
烧杯+生铁样品 |
稀硫酸 |
烧杯+剩余物质 |
|
质量/g |
70.4 |
102.4 |
247.3 |
348.7 |
请计算:(1)该生铁样品中单质铁的质量分数;
(2)经质检部门精确测定,该样品中铁元素的总含量为95.2%(假设没有与硫酸反应的铁都是以Fe3C形式存在),求样品中Fe3C的质量分数。
(1)87.5% (2)8.25%
【解析】
试题分析:(1)烧杯中反应前后减少的质量是逸出氢气的质量,利用铁和硫酸反应的化学方程式,根据氢气的质量可求出单质铁的质量,再根据 ×100%,求出生铁样品中单质铁的质量分数。
×100%,求出生铁样品中单质铁的质量分数。
解:根据质量守恒定律得,H2的质量=(102.4g+247.3g)-348.7g=1 g
设该生铁样品中单质铁的质量为x
Fe + H2SO4 FeSO4 + H2 ↑
56 2
x 1g
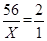
解得,X=28g
根据题意可知,样品的质量=102.4g -70.4g=32 g ,
则Fe%=
答:该生铁样品中单质铁的质量分数为87.5%
(2)样品的质量×样品中铁元素的质量分数=样品中铁元素的总质量,再用样品中铁元素的总质量-单质铁的质量,可求出Fe3C中的铁元素的质量,即32g×95.2%-28g=2.464g;
再根据Fe3C中铁元素的质量分数,求出Fe3C的质量,即2.464g÷ =2.64g;
=2.64g;
最后计算出样品中Fe3C的质量分数= ×100%=8.25%
×100%=8.25%
答:样品中Fe3C的质量分数为8.25%
考点:根据化学反应方程式的计算,元素的质量分数计算
点评:根据化学方程式进行计算时,只要找准对应关系,计算正确即可,但要注意所使用的物质的质量应为参加反应的纯净物的质量,不可把混合物的质量直接代入进行计算。本题的第二小问比较难,做这类型题时应从问题着手倒着向前分析,直到出现已知条件。

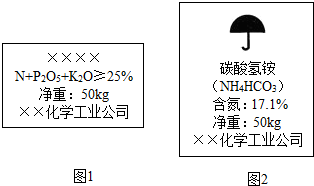
(1)图1中化肥名称:方框中合适的名称应为
(2)小军家小麦生长不茂盛,叶色淡绿.父亲让他去买些化肥回来.到化肥销售点后,
小军根据化肥的品种和价格做出了正确的选择.
| 化肥品种 | K2SO4 | KCl | NH4HCO3 | NH4NO3 | CO(NH2)2 |
| 价格(元/kg) | 0.8 | 0.65 | 0.54 | 1.05 | 1.25 |
(3)化学兴趣小组的同学正在鉴别无标签的五种化肥,它们分别是磷矿粉、碳酸氢铵、氯化钾、尿素、硫酸铵.小红很快从五种化肥中识别出碳酸氢铵,她识别的依据是

(1)图1中化肥名称:方框中合适的名称应为
(2)小军家小麦生长不茂盛,叶色淡绿.到化肥销售点后,小军根据化肥的品种和价格做出了正确的选择,决定购买
| 化肥品种 | K2SO4 | KCl | NH4HCO3 | NH4NO3 | CO(NH2)2 |
| 价格(元/kg) | 0.8 | 0.65 | 0.54 | 1.05 | 1.25 |
如图,是两种常用化肥包装上的说明.

(1)图1中化肥名称:方框中合适的名称应为______(填“复合肥料”“过磷酸钙”“磷矿粉”或“草木灰”);图2提示保存碳酸氢铵时应注意______.
(2)小军家小麦生长不茂盛,叶色淡绿.父亲让他去买些化肥回来.到化肥销售点后,
小军根据化肥的品种和价格做出了正确的选择.
| 化肥品种 | K2SO4 | KCl | NH4HCO3 | NH4NO3 | CO(NH2)2 |
| 价格(元/kg) | 0.8 | 0.65 | 0.54 | 1.05 | 1.25 |
(3)化学兴趣小组的同学正在鉴别无标签的五种化肥,它们分别是磷矿粉、碳酸氢铵、氯化钾、尿素、硫酸铵.小红很快从五种化肥中识别出碳酸氢铵,她识别的依据是______.

(1)图1中化肥名称:方框中合适的名称应为(填“复合肥料”或“过磷酸钙”或“磷矿粉”或“草木灰”),图2提示保存碳酸氢铵应注意.
(2)小军家小麦生长不茂盛,叶色淡绿.到化肥销售点后,小军根据化肥的品种和价格做出了正确的选择,决定购买.
| 化肥品种 | K2SO4 | KCl | NH4HCO3 | NH4NO3 | CO(NH2)2 |
| 价格(元/kg) | 0.8 | 0.65 | 0.54 | 1.05 | 1.25 |
、.