题目内容
通过一年的化学学习,你已经掌握了实验室制取气体的有关规律,以下是老师提供的一些实验装置,根据下图回答下列问题: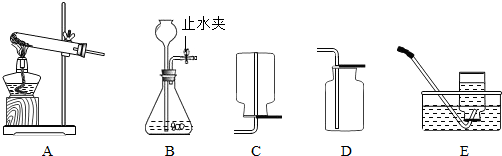
(1)关闭B装置中的止水夹后,从长颈漏斗向锥形瓶中注入一定量的水,静止后如图所示,则B装置是否漏气?
(2)如果实验室用A装置来制取氧气,同时要收集一瓶用于做蜡烛燃烧实验的氧气,则最好的收集方法是
(3)通过查阅资料得知:氨气(NH3)是一种密度比空气小且极易溶于水的气体,其水溶液称为氨水.小枫同学用加热氯化铵和氢氧化钙的固体混合物来制取氨气,写出有关化学方程式
(4)某校化学实验室需要配制1000g溶质质量分数为10%的盐酸用来制取二氧化碳,问需溶质质量分数为38%的盐酸(密度是1.19g/mL)
分析:(1)根据的原理和方法回答.
(2)根据用于做蜡烛燃烧实验的氧气应当干燥判断.
(3)根据氯化铵和氢氧化钙的化学性质书写.
(4)根据溶液稀释时溶质守恒计算.
(2)根据用于做蜡烛燃烧实验的氧气应当干燥判断.
(3)根据氯化铵和氢氧化钙的化学性质书写.
(4)根据溶液稀释时溶质守恒计算.
解答:解:(1)装置气密性检查一般是利用气压变化原理,关闭B装置中的止水夹后,从长颈漏斗向锥形瓶中注入一定量的水,如漏气,装置中的气压逐渐变小,漏斗中液面会下降,如不漏气,装置中的气压增大到一定程度就不再变化,漏斗中会出现一段稳定的水柱.
(2)要收集一瓶用于做蜡烛燃烧实验的氧气,收集的氧气必须干燥,则最好的收集方法是排空气法,由于氧气的密度比空气大,故选D.
(3)氯化铵和氢氧化钙在加热的条件下反应,生成氯化钙、氨气和水,方程式为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O.
(4)由于溶液稀释时溶质守恒,设需溶质质量分数为38%的盐酸(密度是1.19g/mL)XmL,则有1000g×10%=XmL×1.19g/mL×38%,解得X=221.1mL,需要水的体积为
=736.9mL.
故答案为:(1)不漏气;(2)D;(3)2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;(4)221.1;736.9.
(2)要收集一瓶用于做蜡烛燃烧实验的氧气,收集的氧气必须干燥,则最好的收集方法是排空气法,由于氧气的密度比空气大,故选D.
(3)氯化铵和氢氧化钙在加热的条件下反应,生成氯化钙、氨气和水,方程式为:2NH4Cl+Ca(OH)2
| ||
(4)由于溶液稀释时溶质守恒,设需溶质质量分数为38%的盐酸(密度是1.19g/mL)XmL,则有1000g×10%=XmL×1.19g/mL×38%,解得X=221.1mL,需要水的体积为
| 1000g-221.1mL×1.19g/mL |
| 1g/mL |
故答案为:(1)不漏气;(2)D;(3)2NH4Cl+Ca(OH)2
| ||
点评:气体的制取是初中重要的化学实验之一,既是难重点,又是考查热点,理解反应原理,掌握装置的选择依据、气体的检验、验满、收集方法,了解实验步骤和注意事项是解决该类问题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目


