题目内容
【题目】为验证质量守恒定律,我们做了镁条在空气中燃烧的实验。点燃前,先将镁条用_____打磨光亮,再用_____ (填仪器名称) 夹持镁条点燃,观察到的现象是剧烈燃烧、_____、放热、冒出白烟、生成白色固体。充分燃烧后发现石棉网上剩余固体的质量小于反应前镁条的质量,原因可能是_____。某同学还发现产物中有少量黄色固体。
【查阅资料】
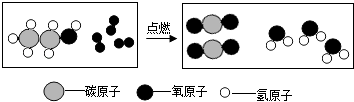
镁能与氮气反应生成黄色的氮化镁固体(Mg3N2),反应的化学方程式是_____。
【反思与交流】
空气中N2的含量远大于O2的含量,而镁条在空气中燃绕生成的氧化镁却远多于氮化镁,原因是_____。
【拓展与迁移】
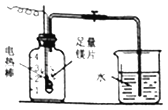
测量空气中氧气含量的实验中,如果装置气密性良好,将红磷换成镁片,反应停止后,冷却至室温,打开止水夹,发现集气瓶内液面_____ (填“高于”、“等于”或“低于”) 集气瓶的刻度1。
【答案】 砂纸 坩埚钳 发出耀眼的白光 生成的氧化镁部分扩散到空气中 3Mg+N2![]() Mg3N2 相同条件下镁更容易和氧气反应 高于
Mg3N2 相同条件下镁更容易和氧气反应 高于
【解析】本题考查了质量守恒定律的实验探究,镁的燃烧实验。
镁条在空气中易形成氧化膜。点燃前,先将镁条用砂纸打磨光亮,除去氧化膜,再用坩埚钳夹持镁条点燃,观察到的现象是剧烈燃烧、发出耀眼的白光、放热、冒出白烟、生成白色固体。充分燃烧后发现石棉网上剩余固体的质量小于反应前镁条的质量,原因可能是生成的氧化镁部分扩散到空气中。
查阅资料:镁能与氮气反应生成黄色的氮化镁固体(Mg3N2),反应的化学方程式是:3Mg+N2![]() Mg3N2;
Mg3N2;
反思与交流:空气中N2的含量远大于O2的含量,而镁条在空气中燃绕生成的氧化镁却远多于氮化镁,原因是相同条件下,镁更容易和氧气反应;
拓展与迁移:测量空气中氧气含量的实验中,如果装置气密性良好,将红磷换成镁片,反应停止后,冷却至室温,打开止水夹,由于氧气约占空气总体积的五分之一,镁燃烧消耗氧气和氮气,最终进入集气瓶中的水的体积大于集气瓶容积的五分之一,因此发现集气瓶内液面高于集气瓶的刻度1。

 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案