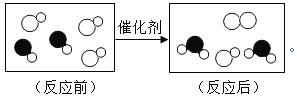
题目内容
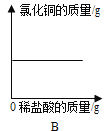
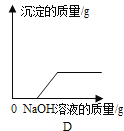
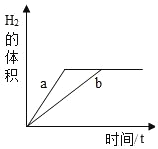
【题目】质量相等的锌和铁分别和质量相等、溶质质量分数也相等的稀盐酸反应,反应情况如图所示。则下列叙述中正确的是
A.金属均反应完,一定有盐酸剩余
B.盐酸均反应完,一定有锌剩余
C.盐酸均反应完,一定有铁剩余
D.图中a、b分别表示铁.锌的反应情况
【答案】C
【解析】
A、金属与酸反应产生的氢气中氢元素全部来自于酸,根据图像可知,质量相等的锌和铁分别和质量相等、溶质质量分数也相等的稀盐酸反应得到的氢气一样多,说明稀盐酸全部参与反应,故A错误;
B、锌和铁与稀盐酸反应的化学方程式分别为:Zn + 2HCl = ZnCl2 + H2↑,Fe + 2HCl = FeCl2 + H2↑,根据化学方程式可知,每65份质量的锌能产生2份质量的氢气,每56份质量的铁能产生2份质量的氢气,根据图像可知,质量相等的锌和铁分别和质量相等、溶质质量分数也相等的稀盐酸反应得到的氢气一样多,等质量的稀盐酸消耗的锌多,因此铁一定有剩余,锌可能有剩余,故B错误;
C、由A、B 选项分析可知,盐酸均反应完,一定有铁剩余,故C正确;
D、由于在金属活动性顺序中,锌排在铁之前,锌的金属活动性比铁强,所以图线a、b分别表示锌、铁的反应情况,故D错误。故选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某化学兴趣小组的同学对实验室一瓶长时间敞口放置的氢氧化钠进行了成分探究。
[预检]小组同学取出少量样品于烧杯中,滴加过量稀盐酸,有气泡产生,证明该样品已经变质。氢氧化钠敞口放置变质的原因是________(用化学方程式表示)。
[提出问题]样品的成分是什么?
[做出猜想]猜想一:部分变质: NaOH和Na2CO3
猜想二:完全变质:_______。
有同学提出:把样品溶于水,然后滴加酚酞,若变红色即可证明还有NaOH存在,样品便为部分变质。立即遭到了其他同学的反对,你认为其他同学反对的理由是______。
[实验探究]
为了进一步确定样品成分,同学们取了部分样品溶于水形成溶液, 做了如下探究:
实验步骤 | 实验记录 | 结论 |
步骤Ⅰ:取少量溶液,向其中滴入过量CaCl2溶液,并过滤; 步骤Ⅱ:取过滤后的滤液,向其中滴入几滴酚酞试液,并观察现象。 | 步骤Ⅱ的现象为______ | 猜想一不成立 |
[反思与拓展]步骤Ⅰ的目的是除去混合物中的Na2CO3,避免对NaOH的检验造成干扰。最后有同学提出可以用Ca(OH)2溶液代替CaCl2溶液,你是否同意?______(填“是“或“否”);理由是______。