题目内容
【题目】实验室需配制10%的氯化钠溶液50g。
(1)甲同学按下图所示步骤依次操作:
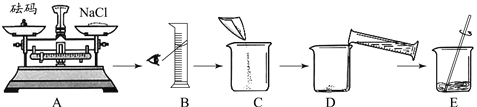
上述操作中错误的操作步骤有_______和________(填字母序号);实验 E中玻璃棒的作用是__________________;
(2)配制10%的氯化钠溶液50 g需要水______ ml;乙同学将准确称量好的氯化钠倒入烧杯中时,不小心有少量氯化钠固体撒出,则所配得的溶液溶质质量分数与10%相比______(选“偏低”、“偏高”或“相等”)。
【答案】 A B 搅拌 45 偏低
【解析】(1)错误的操作步骤有 A,没有按照左物右码的规定称量药品,B没有平视凹液面的最低处; E操作为溶解,其中玻璃棒的作用是搅拌,加速溶解;
(2)配制10%的氯化钠溶液50 g需要氯化钠的质量=50g×10%=5g,该溶液中溶剂水的质量=50g-5g=45g,体积为![]() =45mL;配制溶液过程中,溶质损失,溶液的溶质质量分数会减小。
=45mL;配制溶液过程中,溶质损失,溶液的溶质质量分数会减小。

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案【题目】化学兴趣小组对“锌与稀硫酸反应快慢的影响因素”进行了探究。
【提出问题】锌与稀硫酸反应的快慢受哪些因素的影响呢?
【猜想与假设】①可能与稀硫酸的溶质质量分数有关;②可能与锌的形状有关。
【设计并实验】兴趣小组用100mL不同质量分数的稀硫酸和5g不同形状的锌进行如下实验(时间为3分钟)。

(1)锌与硫酸反应的化学方程式为_______________________________。
(2)如图所示装置收集并测量氢气的体积,则正确的链接顺序是:
氢气→______________________(填导管口序号)。
【收集证据】
(3)要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是______。
【得出结论】依据上表得出的结论是____________________________________。
【反思评价】
(4)下表是兴趣小组第①组实验根据前6分钟记录详细数据(每分钟记录一次产生氢气的体积)。
时段 (均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
H2的体积/mL | 3.1 | 16.7 | 11.9 | 9.6 | 7.6 | 6.0 |
请解释锌与稀硫酸反应由快变慢的原因____________________________________。
(5)锌与硫酸反应的快慢可能还会受_____________因素影响,如果用实验验证该因素对反应快慢的影响,应该控制________________因素不同,而其他因素则相同。