题目内容
 (1)从Ca、C、S、H、O 五种元素中选择适当的元素,按要求写出下列物质的化学式:
(1)从Ca、C、S、H、O 五种元素中选择适当的元素,按要求写出下列物质的化学式:
①造成酸雨的气体________; ②加入汽油可减少的空气污染的一种燃料________;
③中和酸性土壤的碱________; ④易与血红蛋白结合使人中毒的氧化物________.
(2)氢氟酸(HF)可用来在玻璃(主要成分:SiO2)上雕刻各种精美图案,雕刻过程中发生的反应为4HF+SiO2=R↑+2H2O,则R的化学式为________.
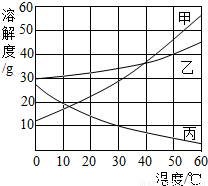
(3)甲、乙、丙三种物质的溶解度曲线如右图所示.据图回答:
①要使接近饱和的丙物质溶液变为饱和,可采取的一种措施是________;
②50℃时,将等质量的甲、乙、丙三种物质的饱和溶液同时降温至10℃时,析出晶体最多的是________,所得溶液中溶质质量分数由大到小的是________.
解:(1)①二氧化硫是造成酸雨的气体,其化学式为:SO2;
②在汽油中加入适量的乙醇作为汽车燃料,可以节省石油资源、减少汽车尾气的污染,乙醇的化学式为:C2H5OH;
③氢氧化钙常用于中和酸性土壤,其化学式为:Ca(OH)2;
④一氧化碳与血红蛋白结合使人中毒,其化学式为:CO;
(2)在化学反应中,反应前后原子的质量、数目、种类都不变,反应前有4个氢原子、4个氟原子、1个硅原子、2个氧原子,硅、氢显正价,氟、氧显负价,反应后的水中有4个氢原子和2个氧原子,可以看出,R中应该有4个氟原子和1个硅原子,正价元素写在前面,负价的元素写在后面,故答案为:SiF4.
(3)①丙的溶解度随着温度的升高而降低,故接近饱和的丙物质溶液变为饱和,可采取增加溶质、蒸发溶剂、升温等方法.
②由溶解度曲线可知,甲物质两温度下的溶解度差值较大,所以降温析出晶体多,在10℃时,乙的溶解度最大,其次是丙,再次是甲,但丙为不饱和溶液,溶质质量小于甲,故所得溶液中溶质质量分数由大到小的是乙、甲、丙.
故答案为:(1)①SO2;②C2H5OH;③Ca(OH)2;④CO;(2)SiF4;(3)①增加溶质、蒸发溶剂、升温;②甲;乙、甲、丙;
分析:(1)根据物质的性质和化合价原则进行分析解答;
(2)根据质量守恒定律,在化学反应中,反应前后原子的质量、数目、种类都不变进行解答.
(3)丙的溶解度随着温度的升高而降低,故接近饱和的丙物质溶液变为饱和,可采取增加溶质、蒸发溶剂、升温等方法;降温到10℃时,析出晶体的多少可通过比较甲乙丙三种物质降温时溶解度的差值来判断.
点评:本题既考查了化学式的书写,还考查了质量守恒定律,记忆溶解度的有关知识,考查较为全面.
②在汽油中加入适量的乙醇作为汽车燃料,可以节省石油资源、减少汽车尾气的污染,乙醇的化学式为:C2H5OH;
③氢氧化钙常用于中和酸性土壤,其化学式为:Ca(OH)2;
④一氧化碳与血红蛋白结合使人中毒,其化学式为:CO;
(2)在化学反应中,反应前后原子的质量、数目、种类都不变,反应前有4个氢原子、4个氟原子、1个硅原子、2个氧原子,硅、氢显正价,氟、氧显负价,反应后的水中有4个氢原子和2个氧原子,可以看出,R中应该有4个氟原子和1个硅原子,正价元素写在前面,负价的元素写在后面,故答案为:SiF4.
(3)①丙的溶解度随着温度的升高而降低,故接近饱和的丙物质溶液变为饱和,可采取增加溶质、蒸发溶剂、升温等方法.
②由溶解度曲线可知,甲物质两温度下的溶解度差值较大,所以降温析出晶体多,在10℃时,乙的溶解度最大,其次是丙,再次是甲,但丙为不饱和溶液,溶质质量小于甲,故所得溶液中溶质质量分数由大到小的是乙、甲、丙.
故答案为:(1)①SO2;②C2H5OH;③Ca(OH)2;④CO;(2)SiF4;(3)①增加溶质、蒸发溶剂、升温;②甲;乙、甲、丙;
分析:(1)根据物质的性质和化合价原则进行分析解答;
(2)根据质量守恒定律,在化学反应中,反应前后原子的质量、数目、种类都不变进行解答.
(3)丙的溶解度随着温度的升高而降低,故接近饱和的丙物质溶液变为饱和,可采取增加溶质、蒸发溶剂、升温等方法;降温到10℃时,析出晶体的多少可通过比较甲乙丙三种物质降温时溶解度的差值来判断.
点评:本题既考查了化学式的书写,还考查了质量守恒定律,记忆溶解度的有关知识,考查较为全面.

练习册系列答案
相关题目
 (2013?宜宾一模)(1)从Ca、C、S、H、O 五种元素中选择适当的元素,按要求写出下列物质的化学式:
(2013?宜宾一模)(1)从Ca、C、S、H、O 五种元素中选择适当的元素,按要求写出下列物质的化学式: