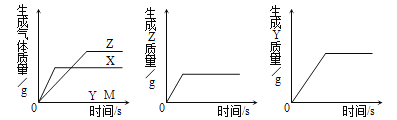
题目内容
【题目】下图中的①、②是氟元素、钙元素在元素周期表中的信息,A.B.C.D是四种粒子的结构示意图。
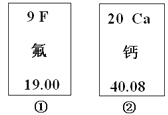
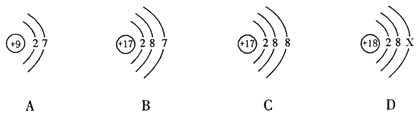
请你回答:
(1)氟元素的相对原子质量为__________,钙元素的原子序数为__________;
(2)X=__________;
(3)A.B.C.D属于同种元素的粒子是________________(填序号);
(4)A粒子的化学性质与B.C.D中哪一种粒子的化学性质相似_____________(填序号);
(5)写出B形成离子的离子符号__________________。
【答案】 19.00 20 8 BC B Cl-
【解析】(1)在元素周期表中,元素名称左上角的数字为原子的序数,右上角是该元素的符号。名称下边的数值是原子的相对原子质量。氟元素的相对原子质量为19.00;同一原子中,质子数=核外电子数=核电荷数=原子序数;钙元素的原子序数为20;(2)X=8;(3)元素是具有相同质子数的同一类原子的总称,因此质子数决定元素的种类,A.B.C.D属于同种元素的粒子是BC;(4)最外层电子数决定原子的化学性质,具有稳定结构的原子化学性质相似;非稳定结构的原子,最外层电子数一样的化学性质相似。A粒子的化学性质与B.C.D中B的化学性质相似;(5)离子是由原子的是电子形成的,失去电子时带正电荷,正电荷数等于失电子数,得电子时带负电荷,负电荷数等于得电子数。离子符号书写:元素(或根)符号右上角的数字表示一个离子带电荷的数值,数字在左,正负号在右,电荷数为1时,1不写;B形成离子的离子符号Cl-。

 名校课堂系列答案
名校课堂系列答案【题目】合金的种类很多,用途非常广泛,黄铜是铜和锌的合金,它可以用来制造机器和电器的零件等,化学兴趣小组的同学欲测定实验室中某铜样品中铜的质量分数(不考虑黄铜中的其他杂质),请你参与他们的探究过程。
称量10g粉末状黄铜样品放入烧杯中,量取45mL稀盐酸分三次加到其中,每次充分反应后,测定生成氢气的质量,实验数据如表:
第一次 | 第二次 | 第三次 | |
加入稀盐酸的体积(ml) | 15 | 15 | 15 |
生成氢气的质量(g) | 0.04 | m | 0.02 |
试求:
(1)m的数值 。
(2)此黄铜样品中铜的质量分数是多少?(写出计算过程)
【题目】高温下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体。小明很好奇,设计如下实验探究铁粉与水蒸气反应后的产物。
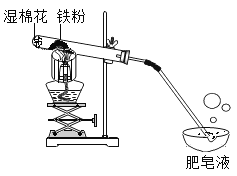
(1)试管尾部放一团湿棉花的目的是 。
(2)探究生成的气体是什么?用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到空中。说明生成的气体是 。写出该反应的化学方程式 。
(3)探究试管中剩余固体成分是什么?
【查阅资料】
常见铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
颜色、状态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
能否被磁铁吸引 | 否 | 否 | 能 |
与盐酸反应 | FeCl2+H2O | FeCl3+H2O | FeCl2+FeCl3+H2O |
【初步验证】
试管中剩余固体为黑色,能全部被磁铁吸引。
【猜想与假设】
猜想一:剩余固体是 ;猜想二:剩余固体是 。
【实验探究】
实验操作 | 实验现象及结论 |
【实验结论】铁和水蒸气反应的化学方程式为 。