题目内容
 已知有些晶体按比例含有一定量特殊的水(称为结晶水),在一定的温度下可脱去结晶水,为了研究草酸亚铁晶体的组成,称取54.0g草酸亚铁晶体在隔绝空气条件下加热,得到剩余固体的质量随温度变化曲线如图所示.已知:温度t1℃时,草酸亚铁晶体完全脱去结晶水,并生成草酸亚铁(FeC2O4)固体;温度t2℃时,草酸亚铁完全分解,发生反应:3FeC2O4
已知有些晶体按比例含有一定量特殊的水(称为结晶水),在一定的温度下可脱去结晶水,为了研究草酸亚铁晶体的组成,称取54.0g草酸亚铁晶体在隔绝空气条件下加热,得到剩余固体的质量随温度变化曲线如图所示.已知:温度t1℃时,草酸亚铁晶体完全脱去结晶水,并生成草酸亚铁(FeC2O4)固体;温度t2℃时,草酸亚铁完全分解,发生反应:3FeC2O4
| ||
(1)根据化学方程式计算草酸亚铁晶体完全脱去结晶水生成FeC2O4的质量.
(2)求该草酸亚铁晶体中结晶水的质量.
(3)求该草酸亚铁晶体中铁元素的质量分数(精确到0.1%).
考点:根据化学反应方程式的计算,化合物中某元素的质量计算
专题:综合计算(图像型、表格型、情景型计算题)
分析:(1)根据题意结合图示可知生成的四氧化三铁的质量,结合草酸亚铁完全分解的化学方程式即可计算出FeC2O4的质量.
(2)54.0g草酸亚铁晶体减去FeC2O4的质量即为结晶水的质量;
(3)根据四氧化三铁中铁元素的质量即为草酸亚铁晶体中铁元素的质量,结合元素质量分数的公式即可解答.
(2)54.0g草酸亚铁晶体减去FeC2O4的质量即为结晶水的质量;
(3)根据四氧化三铁中铁元素的质量即为草酸亚铁晶体中铁元素的质量,结合元素质量分数的公式即可解答.
解答:解:(1)设草酸亚铁晶体完全脱去结晶水生成FeC2O4的质量为x,
3FeC2O4
Fe3O4+4CO↑+2CO2↑
432 232
x 23.2g
=
x=43.2g
(2)该草酸亚铁晶体中结晶水的质量:54.0g-43.2g=10.8g;
(3)四氧化三铁中铁元素的质量:23.2g×
×100%=16.8g
该草酸亚铁晶体中铁元素的质量分数:
×100%=31.1%;
答:(1)草酸亚铁晶体完全脱去结晶水生成FeC2O4的质量是43.2g;
(2)该草酸亚铁晶体中结晶水的质量是10.8g;
(3)该草酸亚铁晶体中铁元素的质量分数是31.1%.
3FeC2O4
| ||
432 232
x 23.2g
| 432 |
| x |
| 232 |
| 23.2g |
x=43.2g
(2)该草酸亚铁晶体中结晶水的质量:54.0g-43.2g=10.8g;
(3)四氧化三铁中铁元素的质量:23.2g×
| 56×3 |
| 232 |
该草酸亚铁晶体中铁元素的质量分数:
| 16.8g |
| 54.0g |
答:(1)草酸亚铁晶体完全脱去结晶水生成FeC2O4的质量是43.2g;
(2)该草酸亚铁晶体中结晶水的质量是10.8g;
(3)该草酸亚铁晶体中铁元素的质量分数是31.1%.
点评:本题考查的是根据化学方程式的计算以及有关化学式计算的综合类计算,需熟练掌握计算步骤与格式.

练习册系列答案
相关题目
近日,各大媒体均曝光了街边调配饮料内幕:售价几元钱的饮料其实是由成本才几毛钱的甜味剂、香精和色素勾兑而成,长期饮用会对人体产生负面影响.糖精(化学式C7H5O3NS)就是一种常见的甜味剂,其甜度是蔗糖的500倍.下列关于糖精的说法中正确的是( )
| A、糖精分子中碳元素的质量分数最大 |
| B、糖精分子中质子数与中子数相等 |
| C、糖精分子中含有5个氢原子 |
| D、糖精分子构成的糖精中氧元素与硫元素质量比为3:2 |
下列物质的应用正确的是( )
A、 食品充稀有气体防腐 |
B、 聚乙烯塑料制插座 |
C、 盐酸用于制药 |
D、 氧气做汽车燃料 |
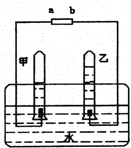 阿伏伽德罗曾经总结出一条定律:在同温同压下,同体积的任何气体里都含有相同的分子数.右图是电解水的简易装置,根据实验结果回答下列问题:
阿伏伽德罗曾经总结出一条定律:在同温同压下,同体积的任何气体里都含有相同的分子数.右图是电解水的简易装置,根据实验结果回答下列问题:
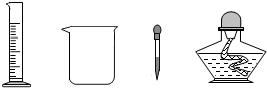
 某同学用如图装置测定空气中氧气的体积分数.请你填写有关空格,并与同学交流.
某同学用如图装置测定空气中氧气的体积分数.请你填写有关空格,并与同学交流.