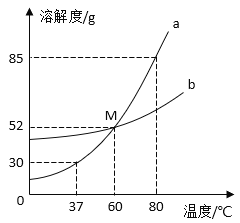
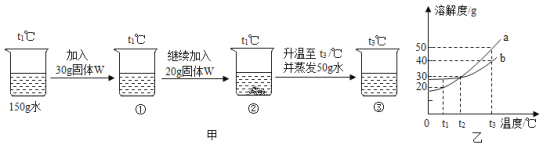
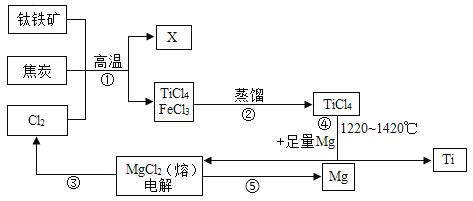
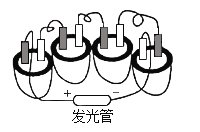
题目内容
【题目】“84”消毒液在日常生活中使用广泛,化学兴趣小组对一瓶敞口久置的“84”消毒液成分产生兴趣,展开探究。
[提出问题]该敞口久置的消毒液中溶质有哪些?
[查阅资料]
(1)“84”消毒液主要成分是次氯酸钠(NaC1O)和氯化钠,其有效成分为次氯酸钠,有腐蚀性并易与空气中CO2反应(![]() )。
)。
(2)NaClO、HClO都具有漂白、杀菌、消毒功效。
(3)HClO不稳定,受热或光照会发生分解。
[分析讨论]小组同学经过讨论,认为该消毒液中的溶质一定有NaCl,可能还有NaClO、Na2CO3、___(填化学式)中的一种或多种。
[实验过程]
I:向装入有色布条的试管中加入适量该消毒液试样,布条长时间不褪色。
II:另取适量该消毒液试样于试管中,加入足量氯化钙溶液,观察到____,实验II的现象说明溶质中有__(填化学式)。
[得出结论]综上所述,该消毒液试样中的溶质为____(填化学式)。
[交流反思] (1)生活中,“84”消毒液贮藏时应注意____保存;
(2)“84”消毒液不能与洁厕灵(主要成分为盐酸)混合使用,因为次氯酸钠与盐酸混合会反应生成一种有毒气体——氯气(Cl2)和两种常见的化合物,请写出该反应的化学方程式____。
【答案】HClO 溶液中有白色沉淀生成 Na2CO3 Na2CO3 、NaCl 密封、避光、低温 ![]()
【解析】
[分析讨论]由于次氯酸钠能与空气中CO2反应,该消毒液中的溶质一定有NaCl,可能还有NaClO、Na2CO3、HClO中的一种或多种。
[实验过程]
II:由于次氯酸钠能与空气中CO2反应,生成碳酸钠,取适量该消毒液试样于试管中,加入足量氯化钙溶液,发生反应:Na2CO3+CaCl2=CaCO3↓+2NaCl,观察到溶液中有白色沉淀生成,实验II的现象说明溶质中有Na2CO3。
[得出结论]向装入有色布条的试管中加入适量该消毒液试样,布条长时间不褪色,证明不含有NaClO、HClO,故该消毒液试样中的溶质为Na2CO3 、NaCl。
[交流反思] (1)生活中,“84”消毒液贮藏时应注意密封、避光、低温保存;
(2)“84”消毒液不能与洁厕灵(主要成分为盐酸)混合使用,因为次氯酸钠与盐酸混合会反应生成一种有毒气体——氯气(Cl2)和两种常见的化合物,该反应的化学方程式为:![]()

 阅读快车系列答案
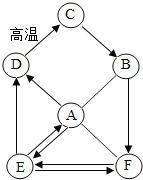
阅读快车系列答案【题目】某化学兴趣小组为鉴别稀盐酸、稀硫酸、Ba(OH)2溶液、Na2CO3溶液和NaCl溶液五瓶无标签的溶液时,将它们随意编号为A、B、C、D、E后进行如下实验:

(1)根据以上实验过程,确定A溶液是_____,C溶液是_____,B、E混合时的现象为:_____;
(2)鉴别后把所有物质混合倒入同一烧杯中,最后发现混合物呈浑浊状,过滤后,滤液呈红色。说明滤液呈_____性,则滤渣的成分是_____;
(3)为了防止滤液污染环境,兴趣小组的同学对滤液的成分展开了探究。
(提出问题)红色滤液中含有的溶质除了石蕊和_____一定存在外,还有什么?
(提出猜想)猜想1:HCl;猜想2:H2SO4;猜想3:H2SO4和_____;猜想4:HCl和_____;猜想5:HCl和Na2SO4等猜想。
(设计方案)
实验方案 | 现象 | 结论 |
取少量红色滤液于试管中加入_____(只加一种物质) | 先有气泡生成,后有白色沉淀,溶液由红色变为蓝色 | 猜想4正确 |