题目内容
(2011?灌云县模拟)某工厂欲从只含有CuSO4的废液中回收金属铜,并得到工业原料硫酸亚铁,其工业流程如下:
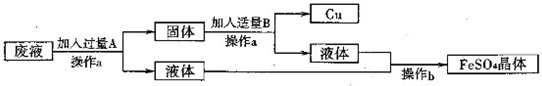
(1)操作a名称是
(2)写出流程中加入适量B反应的化学方程式:
(3)要得到FeSO4固体76g,则向废液中加入A的质量是

(1)操作a名称是
过滤
过滤
、操作b用到的主要仪器有(至少写两种)铁架台、酒精灯、玻璃棒、蒸发皿
铁架台、酒精灯、玻璃棒、蒸发皿
.(2)写出流程中加入适量B反应的化学方程式:
Fe+H2SO4 ═FeSO4+H2↑
Fe+H2SO4 ═FeSO4+H2↑
.(3)要得到FeSO4固体76g,则向废液中加入A的质量是
28
28
g.分析:在金属活动性顺序中,氢前的金属能与酸反应生成盐和氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,故要回收铜得到硫酸亚铁,可以加入铁;铁能溶解于酸,所以加稀硫酸可除去铜中的铁.然后据此解题.
解答:解:(1)经过操作a能得到固体和液体,故a操作为过滤,从液体中得到晶体可以通过蒸发溶液得到,用到的主要仪器有:铁架台、酒精灯、玻璃棒、蒸发皿
(2)铁的金属性比铜强,可置换出硫酸铜中的铜,为使硫酸铜全部反应必须加过量的铁,所以过量的A是铁;铁能溶解于酸,所以加稀硫酸可除去铜中的铁,所以加入的B是稀硫酸.通过操作a后,可以得到单质铜和硫酸亚铁溶液.加入适量B的化学方程式为:Fe+H2SO4═FeSO4+H2↑.
(3)硫酸亚铁中的铁元素的质量等于加入的铁的质量,故铁的质量为76g×
×100%=28g
故答案为:(1)过滤、铁架台、酒精灯、玻璃棒、蒸发皿.
(2)Fe+H2SO4 ═FeSO4+H2↑.
(3)28.
(2)铁的金属性比铜强,可置换出硫酸铜中的铜,为使硫酸铜全部反应必须加过量的铁,所以过量的A是铁;铁能溶解于酸,所以加稀硫酸可除去铜中的铁,所以加入的B是稀硫酸.通过操作a后,可以得到单质铜和硫酸亚铁溶液.加入适量B的化学方程式为:Fe+H2SO4═FeSO4+H2↑.
(3)硫酸亚铁中的铁元素的质量等于加入的铁的质量,故铁的质量为76g×
| 56 |
| 152 |
故答案为:(1)过滤、铁架台、酒精灯、玻璃棒、蒸发皿.
(2)Fe+H2SO4 ═FeSO4+H2↑.
(3)28.
点评:本题考查了铜的回收,完成此题,可以依据金属活动性顺序及其意义进行.

练习册系列答案
相关题目
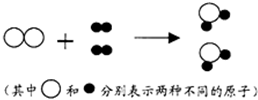 (2011?灌云县模拟)如图表示在一定条件下发生的某化学反应,则下列说法正确的是( )
(2011?灌云县模拟)如图表示在一定条件下发生的某化学反应,则下列说法正确的是( )
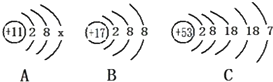 (2011?灌云县模拟)如图为A、B、C三种元素的粒子结构示意图,回答下列问题:
(2011?灌云县模拟)如图为A、B、C三种元素的粒子结构示意图,回答下列问题: