题目内容
将24g由木炭和氧化铜组成的混合物充分加热,其中木炭完全反应,反应结束后将剩余物冷却,称得固体质量为19.6g,请计算:(1)生成二氧化碳多少克?
(2)反应前混合物中氧化铜的质量分数为多少?
【答案】分析:因为碳完全反应所以反应前后固体的质量之差即为碳与氧化铜反应生成的二氧化碳质量,利用该值即可依据方程式求出混合物中碳的质量,进而可求氧化铜的质量以及氧化铜的质量分数;
解答:解:(1)依据质量守恒定律可知生成CO2的质量为24g-19.6g=4.4g;
(2)设混合物中碳的质量为x
C+2CuO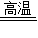 CO2↑+2Cu
CO2↑+2Cu
12 44
x 4.4g
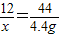
x=1.2g
所以原混合物中碳的质量为1.2克,氧化铜的质量为24g-1.2g=22.8g,反应前混合物中CuO的质量分数为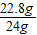 ×100%=95%.
×100%=95%.
答:(1)生成二氧化碳4.4克;
(2)反应前混合物中氧化铜的质量分数为95%;
点评:此题是对化学方程式计算的考查题,解题的关键是掌握固体的质量变化即是生成的二氧化碳的质量.
解答:解:(1)依据质量守恒定律可知生成CO2的质量为24g-19.6g=4.4g;
(2)设混合物中碳的质量为x
C+2CuO
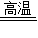 CO2↑+2Cu
CO2↑+2Cu12 44
x 4.4g
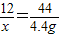
x=1.2g
所以原混合物中碳的质量为1.2克,氧化铜的质量为24g-1.2g=22.8g,反应前混合物中CuO的质量分数为
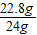 ×100%=95%.
×100%=95%.答:(1)生成二氧化碳4.4克;
(2)反应前混合物中氧化铜的质量分数为95%;
点评:此题是对化学方程式计算的考查题,解题的关键是掌握固体的质量变化即是生成的二氧化碳的质量.

练习册系列答案
相关题目