题目内容
【题目】化学是以实验为基础的科学,根据实验1、实验2回答下列问题: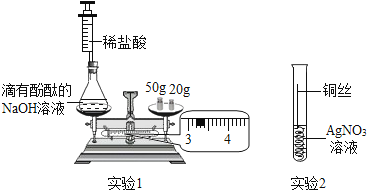
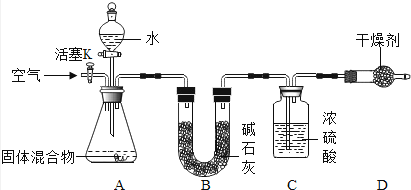
(1)实验1的实验目的是 , 当恰好完全反应时锥形瓶中的现象是: , 图中所示称量的质量是 g.
(2)实验2中可观察到铜丝表面的现象: , 可得出的结论是: .
【答案】验证质量守恒定律(合理即可);溶液由红色变成无色;73.2;铜丝的表面覆盖一层银白色物质,溶液颜色由无色变为蓝色;?铜的金属活动性比银强
【解析】(1)氢氧化钠溶液与稀盐酸反应生成氯化钠和水,当酚酞溶液由红色恰好变为无色时,两者恰好完全反应,反应前后托盘天平保持平衡,说明该反应遵守质量守恒定律.图中所示称量的质量是50g+20g+3.2g=73.2g;
(2)铜的金属活动性比银强铜能与硝酸银溶液反应生成硝酸铜溶液和银,会观察到铜丝的表面覆盖一层银白色物质,溶液颜色由无色变为蓝色;该实验说明铜的金属活动性比银强;
所以答案是:(1)验证质量守恒定律(合理即可);溶液由红色变成无色;73.2;
(2)铜丝的表面覆盖一层银白色物质,溶液颜色由无色变为蓝色;铜的金属活动性比银强.
【考点精析】本题主要考查了金属材料的选择依据和质量守恒定律及其应用的相关知识点,需要掌握黑色金属:通常指铁、锰、铬及它们的合金.重金属:如铜、锌、铅等;有色金属轻金属:如钠、镁、铝等;有色金属:通常是指除黑色金属以外的其他金属;①质量守恒定律只适用于化学变化,不适用于物理变化;②不参加反应的物质质量及不是生成物的物质质量不能计入“总和”中;③要考虑空气中的物质是否参加反应或物质(如气体)有无遗漏才能正确解答此题.

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案【题目】乙炔(C2H2)气体和氧气反应能产生高温火焰,工人师傅常用氧炔焰切割成焊接金属,乙炔由碳化钙(块状固体,化学式为CaC2)与水反应生成,同时生成一种白色固体. ![]()
【查阅资料】电石主要成分为碳化钙(CaC2),它没有可燃性.
【提出问题】白色固体时什么物质?
(1)【做出猜想】小明经过思考认为有以下几种可能:
猜想一:CaO;猜想二:;猜想三:Ca(OH)2;他的依据是 .
(2)【进行实验】
实验步骤 | 实验现象及解释 | 结论 |
取少量白色固体于试管中,滴加稀盐酸 | 猜想二不成立 | |
取少量白色固体加入水中,取上层清液,通入CO2 | 变浑浊,反应的方程式为 | 猜想三成立 |
(3)【交流反思】通过上述实验可知,电石在保护和运输时的注意事项 .