题目内容
【题目】12.0g碳酸钠样品用足量的水配成溶液,加入足量的氯化钙溶液,直到沉淀不再增加.生成白色沉淀与加入氯化钙溶液的质量关系如图,反应的化学方程式: Na2CO3+CaCl2═CaCO3↓+2NaCl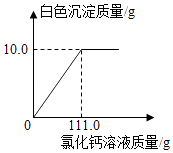
(1)白色沉淀的质量是g.
(2)碳酸钠样品是否为纯净物(写出计算过程)?
【答案】
(1)10.0
(2)解:设参加反应的碳酸钠的质量为x.
Na2CO3+CaCl2═ | CaCO3↓+2NaCl |
106 | 100 |
x | 10.0g |
![]() =
= ![]()
x=10.6g<12.0g
所有碳酸钠样品不是纯净物.
答:碳酸钠样品不是纯净物.
【解析】根据图可知生成的白色沉淀的质量为10.0g,也就是碳酸钙的质量为10.0g,根据碳酸钙的质量和对应的化学方程式求算碳酸钠的质量,进而确定样品是否为纯净物.

练习册系列答案
相关题目