��Ŀ����
������;�㷺����ṹ�����ʵ��ǻ�ѧ����Ҫ�о����ݣ�
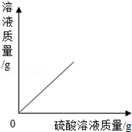
��1����ͼ1������ԭ�ӽṹʾ��ͼ������˵������ȷ������ ����
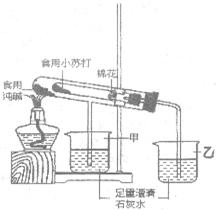
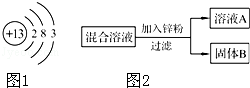
��2��ij��ѧС����һ����NaNO3��Cu��NO3��2�����Һ������ͼ2ʵ�飬������ҺA����B�ijɷֽ����˷�����ʵ��̽����
[�������]��ҺA�е����ʿ�������Щ��
[��������]��ֻ��Zn��NO3��2��Zn ��NO3��2��Cu��NO3��2 ��Zn ��NO3��2��NaNO3
[��������]�����IJ������� �������ţ������������� ����
[ʵ��̽��]ͨ������ʵ���ȷ������B�ijɷ֣��뽫����д������
��3��������¯�н�̿��������ͨ��ȼ���ṩ�������������������ɵĻ�ѧ����ʽΪ�� ����
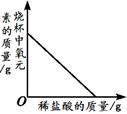
��4����ͭ��Cu��Zn�Ͻ�20g��100gϡ�������ձ���ǡ����ȫ��Ӧ����Ӧ�����ձ���ʣ�����������Ϊ119.6g������ϡ���������ʵ�������������������ȷ��0.1%��

��1����ͼ1������ԭ�ӽṹʾ��ͼ������˵������ȷ������ ����
| A����ԭ���ڷ�Ӧ���õ��� |
| B���ڻ���������ͨ����+3�� |
| C�����ǵؿ��к������Ľ���Ԫ�� |
| D���������������������������õĵ����� |
[�������]��ҺA�е����ʿ�������Щ��
[��������]��ֻ��Zn��NO3��2��Zn ��NO3��2��Cu��NO3��2 ��Zn ��NO3��2��NaNO3
[��������]�����IJ������� �������ţ������������� ����
[ʵ��̽��]ͨ������ʵ���ȷ������B�ijɷ֣��뽫����д������
| ʵ�鲽�� | �� �� | �йط�Ӧ�Ļ�ѧ����ʽ |
| ȡ����B�������μ��� �� | �����ݲ��� | �� ���� ���� |
��4����ͭ��Cu��Zn�Ͻ�20g��100gϡ�������ձ���ǡ����ȫ��Ӧ����Ӧ�����ձ���ʣ�����������Ϊ119.6g������ϡ���������ʵ�������������������ȷ��0.1%��
��1��A����2���ۣ�Zn����NaNO3�뷴Ӧ����������һ������NaNO3
ʵ�鲽�������йط�Ӧ�Ļ�ѧ����ʽ
ϡ���ᣨ��ϡ����ȣ�Zn+2HCl=ZnCl2+H2��
����Zn+H2SO4=ZnSO4+H2����
��3��CO��Fe2O3+3CO 2Fe+3CO2����4��ϡ���������ʵ���������Ϊ19.6%��
2Fe+3CO2����4��ϡ���������ʵ���������Ϊ19.6%��
ʵ�鲽�������йط�Ӧ�Ļ�ѧ����ʽ
ϡ���ᣨ��ϡ����ȣ�Zn+2HCl=ZnCl2+H2��
����Zn+H2SO4=ZnSO4+H2����
��3��CO��Fe2O3+3CO
 2Fe+3CO2����4��ϡ���������ʵ���������Ϊ19.6%��
2Fe+3CO2����4��ϡ���������ʵ���������Ϊ19.6%�������������1��A����ԭ�ӵ�������������3������4�����ڻ�ѧ��Ӧ����ʧȥ���ӣ�˵������B���ڻ���������ͨ����+3�ۣ�˵����ȷ��C�����ǵؿ��к������Ľ���Ԫ�أ�˵����ȷ��D���������������������������õĵ����ԣ�˵����ȷ����2��[��������]�ɽ������˳�����Ӧ�ÿ�֪��Zn���� NaNO3�뷴Ӧ����������һ������NaNO3�����ԣ������IJ����Ǣۣ�[ʵ��̽��]�ɽ������˳�����Ӧ�ÿ�֪��B��һ����ͭ������п����ķ�Ӧ��ȷ���Ƿ���п�����ʵ�����£�
ʵ�鲽�������йط�Ӧ�Ļ�ѧ����ʽ
ϡ���ᣨ��ϡ����ȣ�Zn+2HCl=ZnCl2+H2��
����Zn+H2SO4=ZnSO4+H2����
��3��������¯�н�̿��������ͨ��ȼ���ṩ������CO���������ɵĻ�ѧ����ʽΪ��Fe2O3+3CO
 2Fe+3CO2��
2Fe+3CO2����4��������������20g+100g��119.6g=0.4g
��ϡ���������ʵ���������Ϊx%��
Zn+H2SO4=ZnSO4+H2��
98 2
100g��x% 0.4g
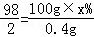 ��ã�x%=19.6%
��ã�x%=19.6%��ϡ���������ʵ���������Ϊ19.6%��

��ϰ��ϵ�д�
 �����������һ��һ��ϵ�д�
�����������һ��һ��ϵ�д�
�����Ŀ