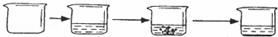题目内容
将一块质量为10g的铜锌合金投入到盛有100g稀硫酸的小烧杯中,恰好完全反应,称的小烧杯中剩余物的总质量为109.8克.请你据此分析并列式计算:
(1)生成氢气的质量为______克.
(2)该铜锌合金中铜的质量为多少克?
(3)求所用稀硫酸中溶质的质量分数?
解:(1)氢气的质量=10g+100g-109.8g=0.2g.
(2)设锌的质量为x,反应的硫酸的质量为y.
Zn+H2SO4═ZnSO4+H2↑
65 98 2
x y 0.2g
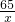 =
=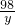 =
=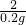
解得:x=6.5g y=9.8g
合金中铜的质量=10g-6.5g=3.5g,
(3)稀硫酸中溶质的质量分数=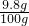 ×100%=9.8%
×100%=9.8%
答:合金中铜的质量是3.5g,稀硫酸中溶质的质量分数是9.8%.
故答案为:(1)0.2;
(2)3.5g;
(3)9.8%.
分析:烧杯中总物质前后减少的质量为氢气的质量,利用锌和硫酸反应的化学方程式,根据氢气的质量求出锌和反应的硫酸的质量,进而求出铜的质量和硫酸溶质的质量分数.
点评:要想解答好这类题目,首先,要理解和熟记根据化学反应方程式的计算步骤和格式,以及与之相关的知识等.然后,根据所给的问题情景结合所学的相关知识和技能,细致地分析题意按照题目要求进行认真地选择或解答即可.
(2)设锌的质量为x,反应的硫酸的质量为y.
Zn+H2SO4═ZnSO4+H2↑
65 98 2
x y 0.2g
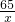 =
=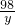 =
=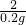
解得:x=6.5g y=9.8g
合金中铜的质量=10g-6.5g=3.5g,
(3)稀硫酸中溶质的质量分数=
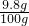 ×100%=9.8%
×100%=9.8%答:合金中铜的质量是3.5g,稀硫酸中溶质的质量分数是9.8%.
故答案为:(1)0.2;
(2)3.5g;
(3)9.8%.
分析:烧杯中总物质前后减少的质量为氢气的质量,利用锌和硫酸反应的化学方程式,根据氢气的质量求出锌和反应的硫酸的质量,进而求出铜的质量和硫酸溶质的质量分数.
点评:要想解答好这类题目,首先,要理解和熟记根据化学反应方程式的计算步骤和格式,以及与之相关的知识等.然后,根据所给的问题情景结合所学的相关知识和技能,细致地分析题意按照题目要求进行认真地选择或解答即可.

练习册系列答案
相关题目
为研究黄铜(铜锌合金)的组成,小江同学找到一块黄铜,使用稀硫酸对其中黄铜中铜的含量进行测定.
| 实验步骤 | ①称取烧杯的质量 | ②将适量稀硫酸 加入烧杯中并称 重 | ③称取少量黄铜样品加 入烧杯中,使之与过量稀 硫酸反应 | ④待反应完全后,称 重 |
| 实验图示 |
| |||
| 实验数据 | 烧杯的质量为50g | 加入稀硫酸的质量为50g | 黄铜样品的质量为10g | 烧杯和其中混合物 的质量为109.9g |
试通过分析计算:
(1)上述实验产生氢气质量为 g.
(2)该黄铜样品中含铜的质量分数为多少?(写出计算过程)
为研究黄铜(铜锌合金)的组成,小江同学找到一块黄铜,使用稀硫酸对其中黄铜中铜的含量进行测定.
试通过分析计算:
(1)上述实验产生氢气质量为______g.
(2)该黄铜样品中含铜的质量分数为多少?(写出计算过程)
| 实验步骤 | ①称取烧杯的质量 | ②将适量稀硫酸 加入烧杯中并称 重 | ③称取少量黄铜样品加 入烧杯中,使之与过量稀 硫酸反应 | ④待反应完全后,称 重 |
| 实验图示 | 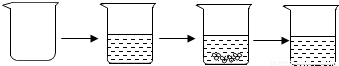 | |||
| 实验数据 | 烧杯的质量为50g | 加入稀硫酸的质量为50g | 黄铜样品的质量为10g | 烧杯和其中混合物 的质量为109.9g |
(1)上述实验产生氢气质量为______g.
(2)该黄铜样品中含铜的质量分数为多少?(写出计算过程)