题目内容
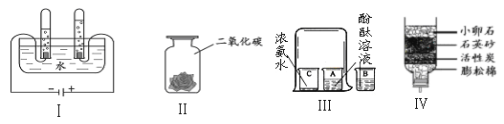
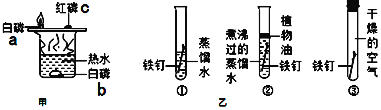
【题目】实验室常用的气体制取装置如图1,请回答:
(1)写出编号仪器的名称:Ⅰ_______________;Ⅱ_______________。
(2)实验室既可以制取CO2,又可以制取O2的发生装置为____________(填装置编号),实验室制取CO2的化学方程式为______________________________。收集一瓶较纯净的O2可以选用的装置是____________(填装置编号)。
(3)某同学利用空塑料输液袋收集二氧化碳(如图2),验满时,把燃着的木条放在玻璃管__________(填“a”或“b”)端,如果熄灭则满了。
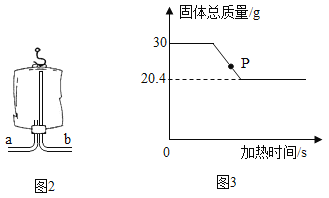
(4)小明用氯酸钾和二氧化锰反应制取氧气,反应中固体总质量随时间变化如图3所示:
①反应生成的氧气质量是__________g。
②计算参加反应的氯酸钾的质量是_______________。(根据化学方程式计算)
③请分析图中 P 点固体的成分:______________________________。
【答案】 试管 锥形瓶 B CaCO3+2HCl![]() CaCl2+H2O+CO2↑ F b 9.6 g 24.5 KClO3、KCl、MnO2
CaCl2+H2O+CO2↑ F b 9.6 g 24.5 KClO3、KCl、MnO2
【解析】(1)根据常见仪器解答;(2)根据碳酸钙与盐酸在常温下反应生成氯化钙、水和二氧化解答解答;根据排水法收集到的气体较为纯净解答;(3)根据二氧化碳的密度比空气大且输液袋倒置解答;(4)根据题中数据及反应的化学方程式计算解答。(1)仪器Ⅰ是试管,仪器Ⅱ是锥形瓶。(2)实验室制取二氧化碳的原理是碳酸钙固体与盐酸常温下反应生成氯化钙、水和二氧化碳,反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;实验室常温下制取氧气的原理是二氧化锰固体与过氧化氢溶液反应生成水和氧气;装置B适用于固液常温下制取二氧化碳或氧气,由于二氧化锰是粉末状固体,所以不能用装置C制备氧气,故实验室既可以制取CO2,又可以制取O2的发生装置为B。氧气不易溶于水,用排水法收集的氧气比较纯净,选用的装置为F。(3)二氧化碳的密度比空气大,应采用向上排空气法收集,利用如图空塑料输液袋收集二氧化碳,应从a口通入二氧化碳气体,空气从b口排出,验满二氧化碳时,把燃着的木条放在玻璃管b端,如果火焰熄火,则收集满了。(4)①由质量守恒定律可知,固体减少的质量即为反应生成的氧气质量,生成氧气的质量为30 g﹣20.4 g=9.6 g;②生成9.6 g氧气需要氯酸钾的质量为x。
2KClO3 ![]() 2KCl+3O2↑
2KCl+3O2↑
245 96
x 9.6 g
![]()
x=24.5 g
③由图像可知,P点所示固体的质量还在继续减少,即氯酸钾还没有完全分解,所以P点处的物质有氯酸钾、二氧化锰和氯化钾。

 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案【题目】馒头、面包等发面食品的一个特点是面团中有许多小孔, 他们使发面食品松软可口。小明学习相关化学知识后, 将家里制作馒头用的白色粉末带到实验室与兴趣小组的同学一起进行探究。
(初步探究)取少量白色粉末于试管中, 加适量水, 测得溶液的 pH >7, 说明溶液呈________________性。
(提出问题)白色粉末成分是什么?
(查阅资料)
(1)碳酸钠、碳酸氢钠都可用于制作发面食品。
(2)碳酸氢钠不稳定, 受热易分解生成二氧化碳和水等; 碳酸钠很稳定。
(猜想与假设)
猜想Ⅰ: 碳酸钠
猜想Ⅱ: 碳酸氢钠
(实验探究)甲乙兴趣小组设计不同实验方案进行探究。
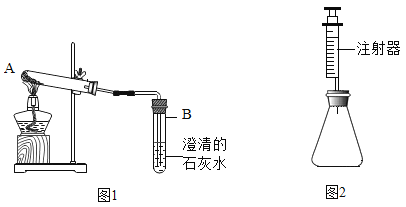
甲组方案: 如图 1取适量白色粉末于试管中, 将导管伸入澄清石灰水, 加热, 澄清石灰水变浑浊, 猜想Ⅱ正确。写出装置 B 中反应的化学方程式__________________。
乙组方案: 用如图 2 所示装置作为反应容器, 准确测量生成气体的体积以判断白色粉末的成分。分别向盛有碳酸钠、碳酸氢钠和白色粉末的锥形瓶中, 注入等体积、等浓度的足量的稀盐酸, 记录如表:
实验编号 | 锥形瓶内物质 | 最终得到 CO2 体积 /ml | |
名称 | 质量 /g | ||
① | 碳酸钠 | a | V1 |
② | 碳酸氢钠 | a | V2 |
③ | 白色粉末 | m | V3 |
实验②的化学反应方程式为______; 表中 m =____g;;根据上表中数据分析, 猜想Ⅱ正确,,判断的依据是____。
(反思应用)
(1)甲组方案中, 无法判断白色粉末是否为碳酸钠和碳酸氢钠的混合物; 乙组方案可以判断, 如果是两者的混合物, 应该满足的条件是______。
(2)家中制作馒头、面包时, 将面粉发酵 ( 产生有机酸) , 再加入适量的碳酸氢钠, 可以使馒头、面包松软。原因是_______。