题目内容
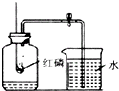 某同学用如右图所示装置来测定空气中氧气的含量.
某同学用如右图所示装置来测定空气中氧气的含量.
请回答下列问题:
(1)该实验中燃烧物为什么用红磷?
(2)实验完成后,若进入集气瓶中的水不足原空气体积的 ,你认为导致这一结果的原因可能是什么?(写一条即可)
,你认为导致这一结果的原因可能是什么?(写一条即可)
(1)该同学考虑到燃烧后的产物五氧化二磷会污染空气,想把红磷改为木炭,他计划对实验稍作改动,你认为他如何来对实验进行改动?
解:(1)在本实验中用的是红磷,红磷只与氧气反应,燃烧后的生成物五氧化二磷是固体,不需要占很大的空间;故答案为:只与氧气反应,且产物是固体;
(2)实验完成后,若进入集气瓶中的水不足原空气体积的 ,原因可能是:红磷的量不足、装置漏气或没有冷却到室温就读数;故答案为:红磷的量不足或装置漏气等;
,原因可能是:红磷的量不足、装置漏气或没有冷却到室温就读数;故答案为:红磷的量不足或装置漏气等;
(3)想把红磷改为木炭,就应该把二氧化碳气体吸收掉,改进的措施是:把集气瓶中的水改为氢氧化钠溶液;故答案为:把集气瓶中的水改为氢氧化钠溶液
分析:本题是测定氧气在空气中的体积分数的实验探究,要把空气中的氧气消耗掉,在本实验中用的是红磷,红磷只与氧气反应,燃烧后的生成物五氧化二磷是固体,不需要占很大的空间.要使本实验成功,必须注意以下几点:①装置的气密性好;②白磷足量;③必须冷却到室温再读数.还要注意白磷在空气中燃烧的现象:发黄光、放出热量、冒出大量的白烟.想把红磷改为木炭,就应该把二氧化碳气体吸收掉,改进的措施是:把集气瓶中的水改为氢氧化钠溶液.
点评:本考点是用红磷测定氧气在空气中的体积分数,属于实验方法和过程的探究.要根据设计的步骤中不同的现象去思考、去探究,从而回答题目给出的问题.本考点主要出现在填空题和实验题中.
(2)实验完成后,若进入集气瓶中的水不足原空气体积的
 ,原因可能是:红磷的量不足、装置漏气或没有冷却到室温就读数;故答案为:红磷的量不足或装置漏气等;
,原因可能是:红磷的量不足、装置漏气或没有冷却到室温就读数;故答案为:红磷的量不足或装置漏气等; (3)想把红磷改为木炭,就应该把二氧化碳气体吸收掉,改进的措施是:把集气瓶中的水改为氢氧化钠溶液;故答案为:把集气瓶中的水改为氢氧化钠溶液
分析:本题是测定氧气在空气中的体积分数的实验探究,要把空气中的氧气消耗掉,在本实验中用的是红磷,红磷只与氧气反应,燃烧后的生成物五氧化二磷是固体,不需要占很大的空间.要使本实验成功,必须注意以下几点:①装置的气密性好;②白磷足量;③必须冷却到室温再读数.还要注意白磷在空气中燃烧的现象:发黄光、放出热量、冒出大量的白烟.想把红磷改为木炭,就应该把二氧化碳气体吸收掉,改进的措施是:把集气瓶中的水改为氢氧化钠溶液.
点评:本考点是用红磷测定氧气在空气中的体积分数,属于实验方法和过程的探究.要根据设计的步骤中不同的现象去思考、去探究,从而回答题目给出的问题.本考点主要出现在填空题和实验题中.

练习册系列答案
相关题目

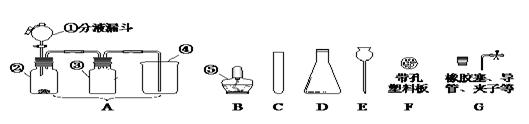
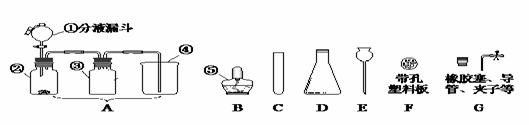
 止,你的正确选择为(填字母) ,反应的化学方程式为 。
止,你的正确选择为(填字母) ,反应的化学方程式为 。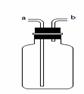 (4)实
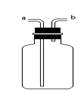
(4)实 验室通常用如右图所示的洗气装置可用于检验二氧化碳气体,
验室通常用如右图所示的洗气装置可用于检验二氧化碳气体, (1)实验操作步骤有:检查气密性,将药品、水、油装入各仪器中,连接并调整好装置后,再进行的操作还有:
(1)实验操作步骤有:检查气密性,将药品、水、油装入各仪器中,连接并调整好装置后,再进行的操作还有: