题目内容
【题目】甲、乙、丙三种固体物质的溶解度曲线如图所示。请回答: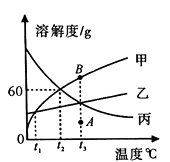
(1)0℃时,三种物质中溶解度最大的是。
(2)t2℃时,在盛有50g水的烧杯中加入35g甲物质,充分搅拌后所得溶液的质量是 g。
(3)将t3℃的甲、乙、丙三种物质的饱和溶液降温到t1℃时,所得溶液中溶质的质量分数关系为(用“=”“<”或“>”符号连接)。
(4)将甲溶液由A点转变为B点,可采用的方法是_(填一种即可)。
(5)如图,将放有固体X的试管放入烧杯中,然后向试管内加入液体Y,一段时间后丙溶液中有固体析出,则对应的X和Y物质是(填序号)。
A.氯化钠和水
B.镁条和稀盐酸
C.硝酸铵和水
D.氢氧化钠和水
【答案】
(1)丙
(2)80
(3)丙>乙=甲
(4)增加溶质或蒸发溶剂
(5)B,D
【解析】(1)由溶解度曲线可知,0℃时,三种物质中溶解度最大的是丙;
(2)t2℃时甲物质的溶解度是60g。即在100g水中最多溶解60g甲物质。那么在50g水中最多溶解30g甲物质。故t2℃时,在盛有50g水的烧杯中加入35g甲物质,充分搅拌后所得溶液的质量是80g;
(3)据图可知:甲、乙的溶解度随温度的升高而增大,且甲物质受温度的影响变化较大,丙的溶解度随温度的升高而减小;所以将t3℃时甲、乙、丙三种物质的饱和溶液降温到t1℃时,甲、乙有晶体析出,而t1℃时甲、乙溶解度相等。此时甲、乙溶质质量分数相等。丙无晶体析出,溶质质量分数不变。据饱和时质量分数的计算式 ![]() ×100%,可知溶解度越大质量分数也就越大,t3℃时丙物质溶质质量分数大于t1℃时甲、乙溶质质量分数。故所得溶液中溶质的质量分数关系为丙> 乙= 甲;
×100%,可知溶解度越大质量分数也就越大,t3℃时丙物质溶质质量分数大于t1℃时甲、乙溶质质量分数。故所得溶液中溶质的质量分数关系为丙> 乙= 甲;
(4)将甲溶液由A点转变为B点,是将不饱和溶液转化为饱和溶液,可采用的方法是增加溶质或蒸发溶剂;
(5)由于丙物质的溶解度随温度的升高而减小。由题意可知,一段时间后丙溶液中有固体析出,说明此时溶液温度升高,丙物质溶解度减小。进而说明固体X与Y混合后放出热量。A中氯化钠和水温度不变;B中镁条和稀盐酸反应温度升高,符号要求;C中硝酸铵遇水温度降低;D中氢氧化钠溶于水温度升高,符号要求.
所以答案是:(1)丙;(2)80;(3)丙>乙=甲;(4)增加溶质或蒸发溶剂;BD.
【考点精析】根据题目的已知条件,利用饱和溶液和不饱和溶液相互转变的方法和固体溶解度的影响因素的相关知识可以得到问题的答案,需要掌握饱和和不饱和的转变方法:①Ca(OH)2和气体等除外,它的溶解度随温度升高而降低②最可靠的方法是:加溶质、蒸发溶剂;影响固体溶解度的因素:①溶质、溶剂的性质(种类) ②温度:大多数固体物的溶解度随温度升高而升高;如KNO3;少数固体物质的溶解度受温度的影响很小;如NaCl;极少数物质溶解度随温度升高而降低.如Ca(OH)2.

 优加精卷系列答案
优加精卷系列答案