题目内容
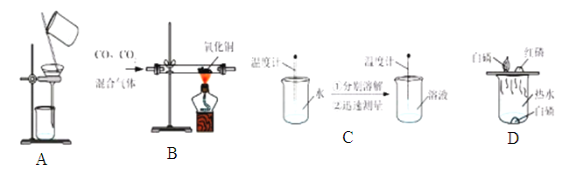
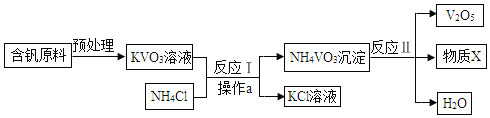
【题目】根据题下图所示装置,结合所学知识回答下列问题。
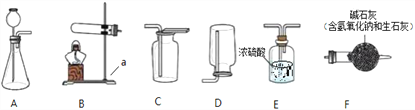
(1)仪器名称a_______;
(2)实验室制取二氧化碳气体的化学方程式为____________________,若要收集干燥的CO2气体,则收集装置为________(选填装置对应的字母)。
(3)实验室常用硫酸吸收氨气,防止污染空气,实验室制备NH3的反应原理为:Ca(OH)2(固)+2NH4Cl(固)![]() CaCl2+2H2O+2NH3↑。现要制备并干燥NH3,所选装置的正确连接顺序为________→________(选择装置对应的字母)。
CaCl2+2H2O+2NH3↑。现要制备并干燥NH3,所选装置的正确连接顺序为________→________(选择装置对应的字母)。
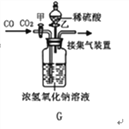
(4)工业上常需分离CO、CO2的混合气体。某同学采用装置G也能达到分离该混合气体的目的,操作步骤如下:
① 关闭活塞乙,打开活塞甲,通入混合气体,可收集到_______气体;
② 然后,________________________(填操作),又可收集到另一种气体,写出该步的化学方程式___________________________。
【答案】 铁架台 CaCO3+2HCl=CaCl2+H2O+CO2↑ EC B F CO 关闭活塞甲,打开活塞乙 Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
【解析】(1)仪器a是铁架台;
(2)实验室通常用大理石或石灰石和稀盐酸反应制取二氧化碳,大理石和石灰石的主要成分是碳酸钙,通常情况下,碳酸钙能和稀盐酸反应生成氯化钙、水和二氧化碳,化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;氧气密度比空气大并且能溶于水,用向上排空气法收集,若要收集干燥的CO2气体,需要用浓硫酸干燥,则收集装置为EC;
(3)实验室制取氨气属于固体加热型,故选发生装置B,浓硫酸与氨气可反应,属于干燥氨气不能用浓硫酸,要用碱石灰,收集干燥的气体用排空气法,氨气的相对分子质量是14+3=17<29,所以用向下排空气法收集;
(4)①一氧化碳不与氢氧化钠溶液反应,而二氧化碳与氢氧化钠溶液反应,所以关闭活塞乙,打开活塞甲,通入混合气体,可收集到一氧化碳;
②二化碳与氢氧化钠溶液反应生成碳酸钠,碳酸钠与稀硫酸反应生成二氧化碳,化学方程式为:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑;所以在完成①之后,关闭活塞甲,打开活塞乙,这时B中的稀硫酸与步骤①中二氧化碳与氢氧化钠溶液反应生成碳酸钠反应,生成二氧化碳,所以此时可收集到二氧化碳。

 高中必刷题系列答案
高中必刷题系列答案【题目】碳酸镁水合物是制备镁产品的中间体。
【制取MgCO33H2O】工业上从弱碱性卤水(主要成分为MgCl2)中获取MgCO33H2O的方法如图1:
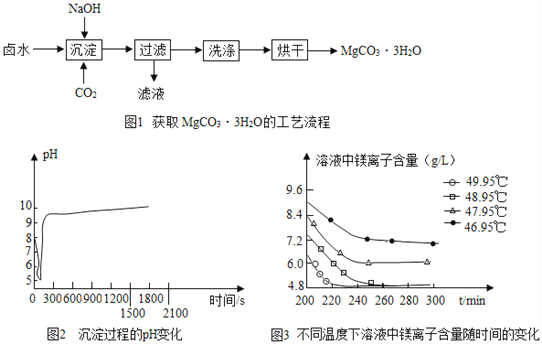
(1)沉淀过程的化学方程式为:MgCl2+CO2+2NaOH+2H2O═MgCO33H2O↓+2_____。
(2)沉淀过程的pH随时间的变化如图2所示,沉淀过程的操作为_______(填标号)。
a.向卤水中滴加NaOH溶液,同时通入CO2
b.向NaOH溶液中滴加卤水,同时通入CO2
c.向卤水中通入CO2至饱和,然后滴加NaOH溶液,同时继续通入CO2
d.向NaOH溶液中通入CO2至饱和,然后滴加卤水,同时继续通入CO2
(3)沉淀过程的溶液中镁离子含量随时间的变化如图3所示,不同温度下所得到沉淀产物如下表所示。
温度(℃) | 产物 |
46.95 | MgCO33H2O |
47.95 | MgCO33H2O |
48.95 | MgCO33H2O |
49.95 | Mg5(OH)2(CO3)44H2O |
则沉淀过程选择的温度为__________,理由是此温度下,Mg2+沉淀的速率较快,沉淀效率较高,且不会生成其它沉淀。
【测定MgCO33H2O的纯度】
【查阅资料】
(1)碱石灰是CaO与NaOH的固体混合物。
(2)MgCO33H2O+H2SO4=MgSO4+CO2↑+4H2O。
(3)Mg5(OH)2(CO3)44H2O也可以表示为Mg(OH)24MgCO34H2O,其相对分子质量为466,能与硫酸反应生成CO2。
【实验步骤】
利用如下图所示装置(图中夹持仪器略去)进行实验,以确定MgCO33H2O的纯度。
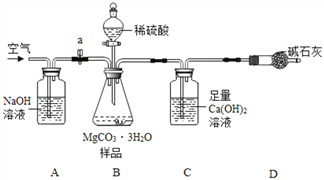
依据实验过程回答下列问题:
(1)实验结束后需持续缓缓通入空气,其作用为______________________。
(2)C装置中反应生成CaCO3的化学方程式为________;D中碱石灰的作用为______________。
(3)下列各项措施中,不能提高测定准确度的是_______(填标号)。
a.在加入硫酸之前,应排净装置内的CO2气体
b.为了缩短实验时间,快速滴加硫酸
c.在A~B之间增添盛有浓硫酸的洗气装置
d.在C装置左侧导管末端增添多孔球泡
(4)小明认为应将C装置中澄清石灰水换成Ba(OH)2溶液,理由一:____________,使CO2被吸收的更完全;理由二: BaCO3的相对分子质量比CaCO3大,等质量的MgCO33H2O生成的BaCO3质量大于CaCO3质量,实验时相对误差小。
(5)实验中准确称取15.0g样品三份,进行三次测定,测得生成CaCO3沉淀的平均质量为10.0g。请计算样品中MgCO33H2O的纯度为___________(写出计算过程)。
(6)若获取MgCO33H2O的样品中含有少量Mg5(OH)2(CO3)44H2O,则样品中MgCO33H2O的纯度_________(填“偏大”“不变”或“偏小”)。