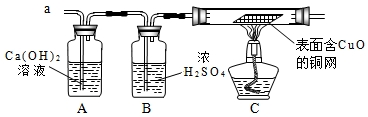
题目内容
某化学实验小组同学将铁粉投入硫酸铜溶液中,发现生成红色固体物质的同时有较多的气泡放出.这一现象激发起同学们的探究欲望,生成的是什么气体?
【提出猜想】从物质组成元素的角度,放出的气体可能是SO2、O2、H2.
【查阅资料】SO2易溶于水,它能与NaOH反应,生成Na2SO3.
【方案设计】依据上述猜想,实验小组同学分别设计了如下方案:
(1)甲同学认为是O2,则检验方法是______.
(2)乙同学认为是SO2,则只需将放出的气体通入盛有NaOH溶液的洗气瓶中,称量通气前后洗气瓶的质量.写出SO2与NaOH反应的化学方程式______.
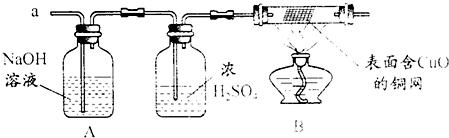
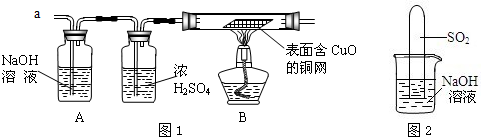
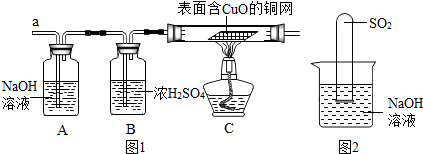
(3)实验小组同学合作设计了如下组合实验方案,排除和验证猜想的气体.
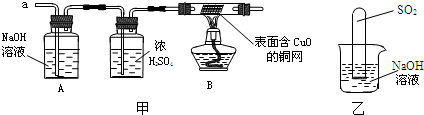
如果放出的是O2和H2,你认为方案中的安全隐患是______.
丙同学认为:为确保安全,实验前应先收集一试管气体,用拇指______,若不发出______,方可采用上面的装置进行实验.
【实验探究】
经丙同学确认安全后,小组同学首先对装置A进行称量,再将收集到的气体从a通入,过一会儿点燃B处酒精灯;一段时间后,发现表面含CuO的铜网由黑色变为光亮的红色;停止通气,再次称量装置A,发现质量无增减.
结论:铁粉与硫酸铜溶液反应时,产生的气体是______.
【思维拓展】
(1)由上述实验可以推出,硫酸铜溶液中可能含有______物质.
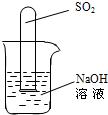
(2)不通过称量,如何判断SO2与NaOH溶液发生了反应呢?有一同学设计了如乙图所示的装置进行实验,发现试管内液面上升,就得出SO2与NaOH溶液发生反应的结论.其他同学认为这一方案不严谨,理由是
______.要得到科学严谨的结论,仍利用该装置,补做的实验是______.
解:【方案设计】
(1)氧气具有助燃性,可以通过检验气体的助燃效果进行判断,故答案为:用带火星的木条试验,看木条是否复燃;
(2)二氧化硫和氢氧化钠反应会生成亚硫酸钠和水,故答案为:SO2 +2NaOH=Na2SO3 +H2O;
(3)氢气和氧气的混合气在加热的过程中可能发生爆炸,故答案为:实验时在B处易发生爆炸事故;
检验氢气的纯度就是收集一试管气体,用拇指 堵住试管口,靠近火焰点火,若不发出尖锐的爆鸣声,表示氢气已经纯净,故答案为:堵住试管口,靠近火焰点火,尖锐的爆鸣声;
【实验探究】
表面含CuO的铜网由黑色变为光亮的红色,说明气体具有还原性,A处质量无增减,所以没有二氧化硫,故答案为:H2;
【思维拓展】
(1)要生成氢气必须是酸和活泼金属反应,故答案为:酸性 (或H2SO4);
(2)二氧化硫极易溶于水,可以将氢氧化钠换成水做对比试验,对比水面上升的高度,故答案为:SO2易溶于水,也能使液面上升,将NaOH溶液换成水做对比实验.
分析:【方案设计】
(1)根据氧气的助燃性进行分析;
(2)根据酸性氧化物会与碱反应生成盐和水进行分析;
(3)根据助燃性气体和可燃性气体加热可能爆炸进行分析;
根据检验氢气纯度的方法进行分析;
【实验探究】
根据二氧化硫会与碱反应进行分析;
【思维拓展】
(1)根据活泼金属和酸反应会生成氢气进行分析;
(2)根据二氧化硫极易溶于水进行分析;
点评:在解此类题时,首先分析题中考查的问题,然后结合所给的知识和学过的知识进行分析解答.
(1)氧气具有助燃性,可以通过检验气体的助燃效果进行判断,故答案为:用带火星的木条试验,看木条是否复燃;
(2)二氧化硫和氢氧化钠反应会生成亚硫酸钠和水,故答案为:SO2 +2NaOH=Na2SO3 +H2O;
(3)氢气和氧气的混合气在加热的过程中可能发生爆炸,故答案为:实验时在B处易发生爆炸事故;
检验氢气的纯度就是收集一试管气体,用拇指 堵住试管口,靠近火焰点火,若不发出尖锐的爆鸣声,表示氢气已经纯净,故答案为:堵住试管口,靠近火焰点火,尖锐的爆鸣声;
【实验探究】
表面含CuO的铜网由黑色变为光亮的红色,说明气体具有还原性,A处质量无增减,所以没有二氧化硫,故答案为:H2;
【思维拓展】
(1)要生成氢气必须是酸和活泼金属反应,故答案为:酸性 (或H2SO4);
(2)二氧化硫极易溶于水,可以将氢氧化钠换成水做对比试验,对比水面上升的高度,故答案为:SO2易溶于水,也能使液面上升,将NaOH溶液换成水做对比实验.
分析:【方案设计】
(1)根据氧气的助燃性进行分析;
(2)根据酸性氧化物会与碱反应生成盐和水进行分析;
(3)根据助燃性气体和可燃性气体加热可能爆炸进行分析;
根据检验氢气纯度的方法进行分析;
【实验探究】
根据二氧化硫会与碱反应进行分析;
【思维拓展】
(1)根据活泼金属和酸反应会生成氢气进行分析;
(2)根据二氧化硫极易溶于水进行分析;
点评:在解此类题时,首先分析题中考查的问题,然后结合所给的知识和学过的知识进行分析解答.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案
相关题目