题目内容
【题目】根据下列实验回答问题. 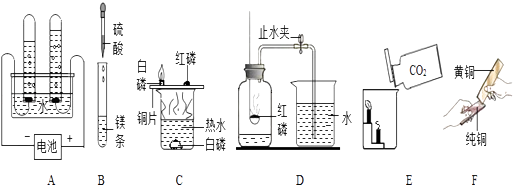
(1)A实验说明水是由组成的.
(2)B实验中的主要现象是 .
(3)C实验说明白磷燃烧需要和条件.
(4)D中发生反应的化学方程式为 ,
(5)E实验说明CO2具有和性质.
(6)F实验可说明 .
【答案】
(1)氢元素和氧元素
(2)剧烈反应,并有大量气泡生成
(3)与氧气接触;温度达到白磷的着火点
(4)4P+5O2 ![]() 2P2O5
2P2O5
(5)密度比空气大;不燃烧也不支持燃烧
(6)黄铜比纯铜的硬度大
【解析】解:(1)A实验是电解水的实验,生成了氢气和氧气,说明水是由氢元素和氧元素组成的;(2)B实验中是镁与稀盐酸的反应,主要现象是剧烈反应,并有大量气泡生成;(3)在C实验中,由水中白磷不燃烧而铜片上的白磷能燃烧,说明了白磷燃烧需要与氧气接触,由铜片上的白磷能燃烧而红磷不能燃烧说明了白磷燃烧需要温度达到白磷的着火点;(4)在D中红磷燃烧生成了五氧化二磷,反应的方程式是:4P+5O2 ![]() 2P2O5;(5)在E实验由下面的蜡烛先熄灭,上面的蜡烛后熄灭.说明了二氧化碳密度比空气大,不燃烧也不支持燃烧;(6)在F中由黄铜在纯铜上刻划能留下刻痕,说明了黄铜比纯铜的硬度大.
2P2O5;(5)在E实验由下面的蜡烛先熄灭,上面的蜡烛后熄灭.说明了二氧化碳密度比空气大,不燃烧也不支持燃烧;(6)在F中由黄铜在纯铜上刻划能留下刻痕,说明了黄铜比纯铜的硬度大.
故答为:(1)氢元素和氧元素;(2)剧烈反应,并有大量气泡生成;(3)与氧气接触,温度达到白磷的着火点;(4)4P+5O2 ![]() 2P2O5 (5)密度比空气大,不燃烧也不支持燃烧;(6)黄铜比纯铜的硬度大
2P2O5 (5)密度比空气大,不燃烧也不支持燃烧;(6)黄铜比纯铜的硬度大
【考点精析】根据题目的已知条件,利用二氧化碳的化学性质和电解水实验的相关知识可以得到问题的答案,需要掌握化学性质:一般情况下不能燃烧,也不支持燃烧,不能供给呼吸;与水反应生成碳酸;能使澄清的石灰水变浑浊;与灼热的碳反应;电解水的实验:A.装置―――水电解器B.电源种类---直流电C.加入硫酸或氢氧化钠的目的----增强水的导电性D.化学反应:2H2O=== 2H2↑+ O2↑.

