题目内容
【题目】请用化学方程式解释下列现象:
(1)小颖同学在探究二氧化碳性质时,将二氧化碳气体通入紫色石蕊溶液,石蕊溶液很快变红色,原因是 ;课后清洗仪器时,小颖发现变红的石蕊溶液又变为紫色,原因是 .
(2)小颖还发现,盛过石灰水的试剂瓶内壁有一层白膜,形成这层白膜的原因是 ;她用少量稀盐酸将其清洗干净,原理是 .
(3)金属与我们的生活息息相关:
①铝是活泼金属,生活中的铝锅却有较强的抗腐蚀性,原因是 .
②工业上用一氧化碳还原赤铁矿(主要成分是Fe2O3)炼铁的化学方程式 .
③为验证某脱氧保鲜剂的主要成分为铁粉,某同学将稀盐酸滴入此脱氧剂中,观察到有气泡生成,并且意外地闻到了一股臭鸡蛋的气味,原来此脱氧剂中除含铁粉外还含有硫化亚铁(FeS).硫化亚铁与稀盐酸发生了化学反应,生成两种新的化合物(温馨提示:铁元素在该反应前后化合价不变),其中有一种是硫化氢气体,试写出该反应的化学方程式 .
【答案】(1)CO2+H2O=H2CO3,H2CO3=CO2↑+H2O;
(2)CO2+Ca(OH)2=CaCO3↓+H2O,CaCO3+2HCl=CaCl2+H2O+CO2↑;
(3)①4Al+3O2=2Al2O3,
②Fe2O3+3CO![]() 2Fe+3CO2,
2Fe+3CO2,
③FeS+2HCl=FeCl2+H2S↑.
【解析】(1)二氧化碳和水反应生成碳酸,化学方程式为:CO2+H2O=H2CO3,碳酸分解生成水和二氧化碳,化学方程式为:H2CO3=CO2↑+H2O;
(2)二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O,碳酸钙和盐酸反应生成氯化钙水和二氧化碳,化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(3)①铝和氧气反应生成氧化铝,化学方程式为:4Al+3O2=2Al2O3;
②一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,化学方程式为:Fe2O3+3CO![]() 2Fe+3CO2;
2Fe+3CO2;
③硫化亚铁和盐酸反应生成硫化亚铁和硫化氢,化学方程式为:FeS+2HCl=FeCl2+H2S↑.

【题目】用科学方法认识和改造物质.请你参与探究并填空:
按照科学认识的过程,科学方法主要蕴含在二个阶段:一是感性认识阶段,主要是为了获得证据,如观察、预测、实验等;二是理性认识(理性思维)阶段,主要是为了形成科学认识,如科学抽象、科学假说,像比较与对比、归纳与演绎等.
在前一阶段的学习中,我们通过实验、观察等手段验证了很多化学反应的发生,运用了“归纳、演绎;比较、对比”等科学的一般方法认识了几种典型的酸、碱、盐.请你运用以上方法认识氯化镁.
(1)用归纳/演绎的方法认识氯化镁的性质
已知下列反应:
HCl+AgNO3═AgCl↓+HNO3
NaCl2+AgNO3═AgCl↓+NaNO2
BaCl2+2AgNO3═2AgCl↓+Ba(NO3)2…
①这组反应能够发生的原因是 .
②由①中得到的规律可以推论“氯化镁溶液也能跟硝酸银溶液反应”,运用的是 的方法.
(2)用实验的方法认识氯化镁的性质
①要验证(1)②中“氯化镁溶液也能跟硝酸银溶液反应”的推论,需进行实验,实验方法是:
实验操作 | 实验现象 | 结论 |
结论:氯化镁溶液能跟硝酸银溶液反应 |
②用实验的方法认识氯化镁的其他性质
实验操作 | 实验现象 | 结论 |
取少量氯化镁溶液于试管中,然后再滴加2﹣3滴紫色石蕊试液,振荡 | 石蕊试液变红 | 结论:氯化镁溶液 |
取少量氯化镁溶液于试管中,然后再滴加氧化钠溶液 | 产生白色沉淀 | 结论: |
(3)用重要的学科实验方法﹣﹣“化学转化法”改造物质
人类利用化学变化,创造出我们所需要的物质,极大地促进了人类社会的发展.工业上以海水为原料,通过一系列化学变化可以得到氯化镁晶体;将无水氯化镁(MgCl2)在熔融状态下,通电后可以得到“国防金属”镁.反应流程如图所示,请从化学视角回答下列问题:
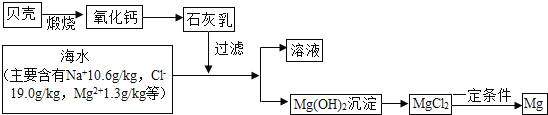
①要使海水中的MgCl2完全转化为沉淀Mg(OH)2,加入石灰乳(主要成分是氢氧化钙)要过量.请同学设计实验确定海水中的MgCl2已全部转化为Mg(OH)2;取上层清液少量于试管中,向其中加入 ,观察到 ,说明海水的MgCl2已全部转化为Mg(OH)2.
②要将沉淀出的氢氧化镁转化为氯化镁,可以选用的试剂是 .
③海水中本来就有氯化镁,请分析从海水中制取MgCl2时,要经历“MgCl2→Mg(OH)2→MgCl2”的转化过程的原因: .