题目内容
【题目】(6分)为测定氯化钠和碳酸钠混合物的组成情况,某研究小组进行了如下实验。
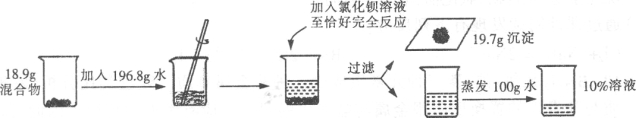
请回答下列问题:
(1)实验中发生反应的化学方程式为
(2)求解混合物中发生反应物质的质量(x)的比例式为
(3)混合物中氯化钠和碳酸钠质量的最简整数比为 。
(4)在滴加氯化钡溶液的过程中,烧杯中各溶质质量的变化情况为
(5)所用氯化钡溶液中溶质质量分数为 。
【答案】(1)Na2CO3+BaCl2==BaCO3↓+2NaCl
(2)106/197=x/19.7g
(3)83:106
(4)碳酸钠减少至消失,氯化钠增多
(5)20%
【解析】
试题分析:(1)向氯化钠和碳酸钠的溶液中加入氯化钡溶液,氯化钡会与碳酸钠反应生成碳酸钡沉淀和氯化钠:Na2CO3+BaCl2==BaCO3↓+2NaCl ;
(2)根据提供的数据可知,碳酸钠与氯化钡反应最终生成的沉淀的质量为19.7g,那么可以根据生成的沉淀的质量计算出碳酸钠的质量。
设碳酸钠的质量为x,那么:
Na2CO3+BaCl2==BaCO3↓+2NaCl
106 197
X 19.7g
106/197=x/19.7g
X=10.6g
(3)氯化钠和碳酸钠混合物的总质量为18.9g,那么氯化钠的质量=18.9g-10.6g=8.3g,
故混合物中氯化钠和碳酸钠质量的比=8.3:10.6=83:106 ;
(4)在滴加氯化钡溶液的过程中,由于碳酸钠会与氯化钡反应生成氯化钠,故碳酸钠的质量减小,氯化钠的质量增加;
(5)利用化学方程式,根据反应的质量比可计算出氯化钡溶液中溶质的质量和生成了氯化钠的质量。
设氯化钡溶液中溶质的质量为y,生成的氯化钠的质量为z,
Na2CO3+BaCl2==BaCO3↓+2NaCl
208 197 117
Y 19.7g z
208/197=y/19.7g 117/197=z/19.7g
Y=20.8g z=11.7g
反应后的溶液中溶质氯化钠的质量=8.3g+11.7g=20g
根据溶液蒸发水前后溶质的质量不变,那么设原溶液的质量为a ,那么:
20g/(a-100g) ×100% =10%
a=300g
那么加入的氯化钡溶液的质量=300g-(18.9g+196.8g-19.7g)=104g
故加入的氯化钡溶液的溶质质量分数=20.8g/104g ×100%=20%
答:略