题目内容
【题目】请根据下图所示的实验过程和提供的数据计算:
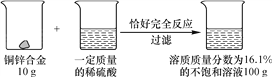
(1)最终生成的不饱和溶液中溶质的质量为________。
(2)合金中铜的质量分数________。
(3)求所加稀硫酸的溶质质量分数。
【答案】(1)16.1 g;(2)35%;(3)10.5%
【解析】(1)最终生成的不饱和溶液中溶质的质量为100g×16.1%=16.1g。
(2)解∶设为合金中铜的质量分数为x,硫酸质量为y,生成氢气质量为Z
Zn+H2SO4 =ZnSO4+H2↑
65 98 161 2
1-10g×x y 16.1g z
![]() =
=![]() ,x=35%
,x=35%
![]() =
=![]() ,z=0.2g
,z=0.2g ![]() =
=![]() ,y=9.8g
,y=9.8g
(3)所加稀硫酸的溶质质量分数∶![]() ×100%=10.5%
×100%=10.5%
答∶(1)最终生成的不饱和溶液中溶质的质量为16.1 g。(2)合金中铜的质量分数是35%。(3)所加稀硫酸的溶质质量分数是10.5%。
点睛∶正确书写化学方程式和灵活应用质量守恒定律是做好本题的关键。

练习册系列答案
相关题目