题目内容
 28、小亮在做家庭小实验时,欲探究从资料上获知的:家用发酵粉(主要成分是NaHCO3)在焙制糕点时,受热分解成Na2CO3、CO2和水而使糕点发酵的原理.请你结合他的探究过程回答下列问题:
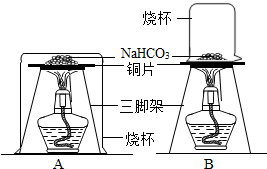
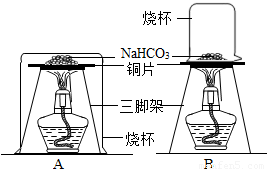
28、小亮在做家庭小实验时,欲探究从资料上获知的:家用发酵粉(主要成分是NaHCO3)在焙制糕点时,受热分解成Na2CO3、CO2和水而使糕点发酵的原理.请你结合他的探究过程回答下列问题:(1)小亮设计了如图所示的两个实验装置,还备了一瓶石灰水.你认为装置
B
(填序号)比较合理,在实验中烧杯内壁上可看到的现象是有水珠生成
;(2)证明烧杯内有CO2气体的实验操作是
把烧杯倒转过来,加入少量澄清石灰水,振荡,观察现象
;(3)干粉灭火剂的主要成分也是NaHCO3,其灭火原理是
NaHCO3受热后分解生成大量可以灭火的CO2
;(4)如果Na2CO3中混有少量的NaHCO3,欲除去其中的NaHCO3,应采取的方法是
加热
.分析:(1)水蒸气遇冷后才会凝结成小水珠,A、B两个装置的烧杯相比,A烧杯把酒精灯扣了进去,温度较高,烧杯内壁不会产生水珠.
(2)检验二氧化碳气体就用澄清石灰水,石灰水变浑浊证明有二氧化碳气体存在.
(3)NaHCO3分解能产生二氧化碳,有二氧化碳的性质可知它可以灭火.
(4)除杂首选的是物理方法,如果物理方法不行再考虑化学方法,但除杂的原则是不能引入新的杂质.
(2)检验二氧化碳气体就用澄清石灰水,石灰水变浑浊证明有二氧化碳气体存在.
(3)NaHCO3分解能产生二氧化碳,有二氧化碳的性质可知它可以灭火.
(4)除杂首选的是物理方法,如果物理方法不行再考虑化学方法,但除杂的原则是不能引入新的杂质.
解答:解:(1)因为NaHCO3分解后有水生成,所以在倒扣的烧杯上应该有水珠.但是A烧杯把酒精灯一块扣了进去,而B烧杯只扣的是反应物.所以A烧杯中温度较高,反应产生的水蒸气不会遇冷凝结成小水珠;而B烧杯温度较低,反应产生的水蒸气遇到冷的烧杯内壁会形成小水珠.
(2)证明烧杯内有CO2气体的方法是用澄清石灰水来检验,所以应该在反应一段时间后,把上面B装置中的烧杯倒转过来,加入少量澄清石灰水,振荡,并观察现象,如果石灰水变浑浊证明有二氧化碳气体存在.
(3)因为NaHCO3分解后能产生二氧化碳,二氧化碳既不燃烧也不支持燃烧,所以二氧化碳可用来灭火,这也是干粉灭火器主要的灭火原理.
(4)如果Na2CO3中混有少量的NaHCO3,因为NaHCO3受热可分解生成Na2CO3、CO2和水,CO2和水蒸气逸出后就只剩下Na2CO3,而Na2CO3不会受热分解,所以采用直接加热的方法可除去Na2CO3中的NaHCO3.
故答案为:(1)B,有水珠生成;
(2)把烧杯倒转过来,加入少量澄清石灰水,振荡,观察现象;
(3)NaHCO3受热后分解生成大量可以灭火的CO2;
(4)加热.
(2)证明烧杯内有CO2气体的方法是用澄清石灰水来检验,所以应该在反应一段时间后,把上面B装置中的烧杯倒转过来,加入少量澄清石灰水,振荡,并观察现象,如果石灰水变浑浊证明有二氧化碳气体存在.
(3)因为NaHCO3分解后能产生二氧化碳,二氧化碳既不燃烧也不支持燃烧,所以二氧化碳可用来灭火,这也是干粉灭火器主要的灭火原理.
(4)如果Na2CO3中混有少量的NaHCO3,因为NaHCO3受热可分解生成Na2CO3、CO2和水,CO2和水蒸气逸出后就只剩下Na2CO3,而Na2CO3不会受热分解,所以采用直接加热的方法可除去Na2CO3中的NaHCO3.
故答案为:(1)B,有水珠生成;
(2)把烧杯倒转过来,加入少量澄清石灰水,振荡,观察现象;
(3)NaHCO3受热后分解生成大量可以灭火的CO2;
(4)加热.
点评:此题利用NaHCO3受热分解来设计题目,其中考查了二氧化碳的性以及除杂等知识,涉及的知识面较广,知识基础,是一道不错的题目.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 小亮在做家庭小实验时,欲探究从资料上获知的:家用发酵粉(主要成分是NaHCO3)在焙制糕点时,受热分解成Na2CO3、CO2和水而使糕点发酵的原理.请你结合他的探究过程回答下列问题:
小亮在做家庭小实验时,欲探究从资料上获知的:家用发酵粉(主要成分是NaHCO3)在焙制糕点时,受热分解成Na2CO3、CO2和水而使糕点发酵的原理.请你结合他的探究过程回答下列问题: