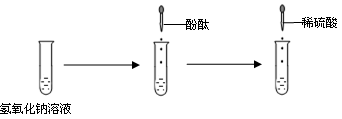
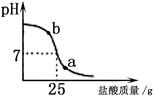
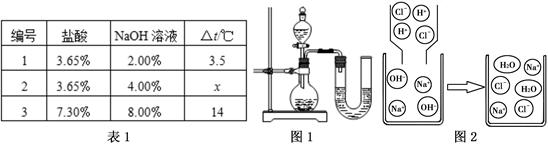
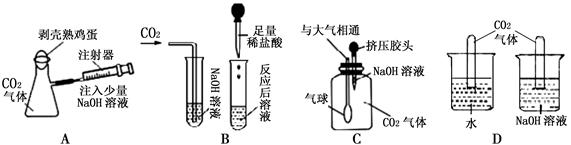
题目内容
胃酸的主要成分是盐酸,胃酸过多的病人需用药物治疗.下列药物(主要成分)不能用于治疗胃酸过多是
| A.NaOH | B. NaCl | C. CaCO3 | D. NaHCO3 |
AB
试题分析:氢氧化钠具有强烈的腐蚀性,不能用于治疗胃酸过多;氯化钠不能与盐酸反应,也不能治疗胃酸过多;碳酸钙是固体,能与盐酸反应生成氯化钙、水和二氧化碳,能用于治疗胃酸过多;碳酸氢钠也能与盐酸反应生成氯化钠、水和二氧化碳,也能用于治疗胃酸过多。故选AB。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目