题目内容
完成下列反应的化学方程式,并回答有关问题.(1)实验室用双氧水制取氧气(二氧化锰粉末作催化剂):
(2)生石灰与水生成熟石灰的反应:
(3)氢氧化钡溶液和稀硫酸恰好完全反应:
(4)铁钉加入到硫酸铜溶液中:
(5)某些工厂用稀盐酸清洗铁制品表面的铁锈(主要成分氧化铁):
(2)根据氧化钙和水会生成氢氧化钙进行分析;
(3)根据复分解反应的原理和反应后溶液中的成分进行分析;
(4)铁放入硫酸铜溶液中时铁能置换出硫酸铜中的铜;
(5)根据铁锈的成分为三氧化二铁分析即可.
| ||
(2)氧化钙与水反应生成氢氧化钙同时放出热量;
(3)氢氧化钡和硫酸反应生成硫酸钡沉淀和水,反应前的氢氧化钡和硫酸都是电解质,导电性强,反应后几乎不存在电解质;
(4)铁与硫酸铜反应生成硫酸亚铁和铜,该反应的化学方程式为:Fe+CuSO4═Cu+FeSO4;该反应由一种单质和一种化合物反应生成另一种单质和另一种化合物,符合置换反应的概念,因此该反应属于置换反应;
(5)某铁锈的主要成分是三氧化二铁,会与稀盐酸反应,生成黄色的氯化铁溶液.
故答案为:(1)2H2O2
| ||

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案小黎同学为了进一步加深对“碱的化学性质”的理解,特邀你协助完成下列活动与探究:?
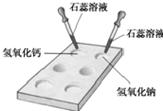
(1) 如右图所示,在白色点滴板上进行实验,请将实验现象填入下表:
|
| 氢氧化钠溶液 | 氢氧化钙溶液 |
| 加紫色石蕊溶液 | 56 | 57 |
(2)回忆检验二氧化碳气体的反应,写出该反应的化学方 程式 58 。?
(3)三氧化硫(SO3)与氢氧化钠反应与上面的反应类似,写出这一反应的化学方程式?
59 。?
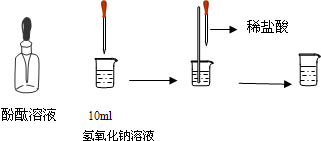
(4)如右图所示,在烧杯中加入10mL氢氧化钠溶液,滴入几滴酚酞试液,溶液显 60 色,再用滴管慢慢滴入稀盐酸,并不断搅拌溶液,至溶液颜色恰好变成无色为止。这一实验说明:酸与碱作用生成了盐和水,这一反应叫做 61 反应。?
(5)根据上面的实验和讨论,试归纳出氢氧化钠、氢氧化钙有哪些相似的化学性质。(任写两点)?
① 62
② 63
小黎同学为了进一步加深对“碱的化学性质”的理解,特邀你协助完成下列活动与探究:?
(1) 如右图所示,在白色点滴板上进行实验,请将实验现象填入下表:

|
|
氢氧化钠溶液 |
氢氧化钙溶液 |
|
加紫色石蕊溶液 |
56 |
57 |
(2)回忆检验二氧化碳气体的反应,写出该反应的化学方 程式 58 。?
(3)三氧化硫(SO3)与氢氧化钠反应与上面的反应类似,写出这一反应的化学方程式?
59 。?
(4)如右图所示,在烧杯中加入10mL氢氧化钠溶液,滴入几滴酚酞试液,溶液显 60 色,再用滴管慢慢滴入稀盐酸,并不断搅拌溶液,至溶液颜色恰好变成无色为止。这一实验说明:酸与碱作用生成了盐和水,这一反应叫做 61 反应。?

(5)根据上面的实验和讨论,试归纳出氢氧化钠、氢氧化钙有哪些相似的化学性质。(任写两点)?
① 62
② 63
(1)如图所示,在白色点滴板上进行实验,请将实验现象填入下表:
| 氢氧化钠溶液 | 氢氧化钙溶液 | |
| 加紫色石蕊溶液 | ______ | ______ |
(3)三氧化硫(SO3)与氢氧化钠反应与上面的反应类似,写出这一反应的化学方程式______.
(4)如图所示,在烧杯中加入10mL氢氧化钠溶液,滴入几滴酚酞试液,溶液显______色,再用滴管慢慢滴入稀盐酸,并不断搅拌溶液,至溶液颜色恰好变成无色为止.这一实验说明:酸与碱作用生成了盐和水,这一反应叫做______反应.
(5)根据上面的实验和讨论,试归纳出氢氧化钠、氢氧化钙有哪些相似的化学性质.(任写两点)?
①______
②______.


(1)如图所示,在白色点滴板上进行实验,请将实验现象填入下表:
| 氢氧化钠溶液 | 氢氧化钙溶液 | |
| 加紫色石蕊溶液 | ______ | ______ |
(3)三氧化硫(SO3)与氢氧化钠反应与上面的反应类似,写出这一反应的化学方程式______.
(4)如图所示,在烧杯中加入10mL氢氧化钠溶液,滴入几滴酚酞试液,溶液显______色,再用滴管慢慢滴入稀盐酸,并不断搅拌溶液,至溶液颜色恰好变成无色为止.这一实验说明:酸与碱作用生成了盐和水,这一反应叫做______反应.
(5)根据上面的实验和讨论,试归纳出氢氧化钠、氢氧化钙有哪些相似的化学性质.(任写两点)?
①______
②______.