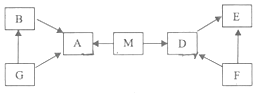
��Ŀ����
����Ŀ��Ϊ�ⶨij����п��Ʒ��п���ʵ�������������ȡ����Ʒ������ͼ��ʾʵ�飮���ʵ����������ݣ�ƽ��ֵ�����±���
��Ӧǰ���� | ��ַ�Ӧ������ | |
װ��+ϡ���ᣨ������ | п��Ʒ | װ��+ʣ������ |
342.10g | 16.00g | 357.70g |
ʵ���з�����Ӧ��Zn+H2SO4=ZnSO4+H2������п��Ʒ�����ʲ��μӷ�Ӧ���Ҳ�����������ˮ����������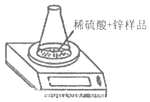
��1����������������Ϊ g
��2����п��Ʒ��п���ʵ�����������Ҫ��д��������̣�
���𰸡�
��1��0.40
��2��
�⣺���������غ㶨�ɿ�֪�����ɵ�����������Ϊ342.10g+16.00g��357.70g=0.40g
��п���ʵ�����Ϊx��
Zn+ | H2SO4 | = | ZnSO4+ | H2�� |
65 | 2 | |||
x | 0.40g |
![]() =
= ![]()
x=13.00g
��Ʒ��п���ʵ���������Ϊ ![]() ��100%=81.25%
��100%=81.25%
���������⣺��1�����������غ㶨�ɣ�m��H2��=342.10+16-357.70=0.4��g����
�����㾫����������Ҫ�����˸��ݻ�ѧ��Ӧ����ʽ�ļ�������֪ʶ�㣬��Ҫ���ո����ʼ�������=ϵ������Է�������֮�Ȳ�����ȷ�����⣮

��ϰ��ϵ�д�
�����Ŀ