题目内容
【题目】下表是元素周期表中1﹣18号元素的排列情况.根据此表我对它进行探究:
(1)第16号元素的名称是 . 通过对元素周期表的分析,我能得出的一条信息是 .
(2)第16号元素属于元素(填“金属”或“非金属”),它的原子在化学反应中容易电子(填“得”或“失”),它的离子符号为 .
(3)研究表明:在同一周期中,从左到右,原子失去电子的能力逐渐减弱,得到电子的能力逐渐增强.由此推断:第二周期中得电子能力最强的是原子;失电子能力最强的是原子,具有稳定结构的是原子.
(4)某元素的原子结构示意图为 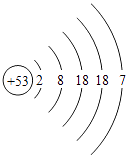 ,则它位于元素周期表中的第周期,该元素的化学性质与上表中第族元素的化学性质相似.
,则它位于元素周期表中的第周期,该元素的化学性质与上表中第族元素的化学性质相似.
【答案】
(1)硫;相同周期元素电子层数相同(或同族元素最外层电子数一般相同)
(2)非金属;得;S2﹣
(3)F;Li;Ne
(4)五;ⅦA
【解析】解:(1)第16号元素的核电荷数是16,名称是硫;通过对元素周期表的分析,可以看出相同周期的元素电子层数相同,相同族的元素最外层电子数一般相同.(2)根据原子结构示意图和金属元素的原子最外层电子数一般少于4个,非金属元素的原子最外层电子数一般多于4个,可知16号元素最外层电子数是6大于4是非金属元素;由非金属元素在化学反应中易得到电子,形成阴离子可知,硫在化学反应中常得到两个电子而形成带两个单位负电荷的硫离子.(3)因为从同周期中从左到右,原子失去电子的能力逐渐减弱,得到电子的能力逐渐增强,所以第二周期中得电子能力最强的是9号元素F,失电子能力最强的应该是3号元素Li,具有稳定结构的原子,最外层一般是8个电子(或只有一个电子层两个电子)的原子,第二周期中元素Ne是具有稳定结构的原子.(4)因为同周期的元素电子层数相同,且周期数等于电子层数,所以 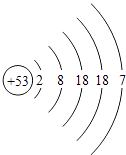 是第五周期的元素,化学性质相似即是最外层电子数相同,其最外层电子数是7,所以该元素与第7主族的元素化学性质相似. 所以答案是:(1)硫;相同周期元素电子层数相同(或同族元素最外层电子数一般相同);(2)非金属;得;S2﹣;(3)F、Li、Ne;(4)五;ⅦA.
是第五周期的元素,化学性质相似即是最外层电子数相同,其最外层电子数是7,所以该元素与第7主族的元素化学性质相似. 所以答案是:(1)硫;相同周期元素电子层数相同(或同族元素最外层电子数一般相同);(2)非金属;得;S2﹣;(3)F、Li、Ne;(4)五;ⅦA.
