题目内容
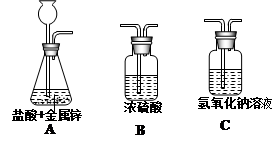
27、实验室用盐酸和锌粒制取氢气时,由于盐酸的挥发性,在得到的氢气中常常含有一定量的氯化氢气体和水蒸气.在实验室可用右图装置除去其中的杂质而得到较纯净的氢气.其回答下列有关问题:
(1)装置A中反应的化学方程式为:
(2)制取干燥的氢气时,装置的导管正确顺序是(填字母):A→
(3)若要收集干燥的氢气应选择的方法是:

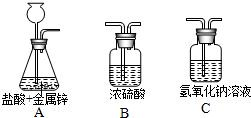
(1)装置A中反应的化学方程式为:
Zn+2HCl=ZnCl2+H2↑
.(2)制取干燥的氢气时,装置的导管正确顺序是(填字母):A→
C
→B
.其中C装置的作用是:吸收氯化氢气体
.(3)若要收集干燥的氢气应选择的方法是:
制出的气体通入浓硫酸后,再收集
.分析:实验室用盐酸和锌粒制取氢气时,由于盐酸的挥发性,在得到的氢气中常常含有一定量的氯化氢气体和水蒸气.除去其中的杂质而得到较纯净干燥的氢气,则需要进行用氢氧化钠溶液吸收氯化氢气体,用浓硫酸吸收水蒸气.并且顺序一定,不能颠倒.
解答:解:(1)已知反应物盐酸和金属锌,可以书写化学方程式Zn+2HCl=ZnCl2+H2↑;
(2)制取干燥的氢气时,用氢氧化钠溶液吸收氯化氢气体,用浓硫酸吸收水蒸气.所以顺序为A→C→B.
(3)若要收集干燥的氢气,用浓硫酸吸收水蒸气后,在进行收集.
故答为:(1)Zn+2HCl=ZnCl2+H2↑ (2)A→C→B 吸收氯化氢气体 (3)制出的气体通入浓硫酸后,再收集.
(2)制取干燥的氢气时,用氢氧化钠溶液吸收氯化氢气体,用浓硫酸吸收水蒸气.所以顺序为A→C→B.
(3)若要收集干燥的氢气,用浓硫酸吸收水蒸气后,在进行收集.
故答为:(1)Zn+2HCl=ZnCl2+H2↑ (2)A→C→B 吸收氯化氢气体 (3)制出的气体通入浓硫酸后,再收集.
点评:本题考查实验步骤的注意事项,了解盐酸的物理性质和气体的收集方法,掌握碱的化学性质.

练习册系列答案
相关题目