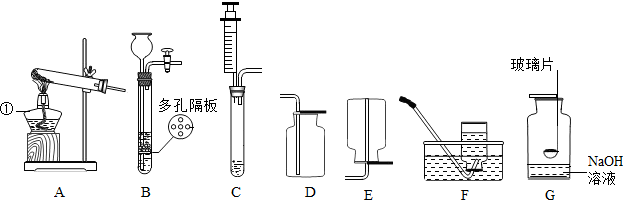
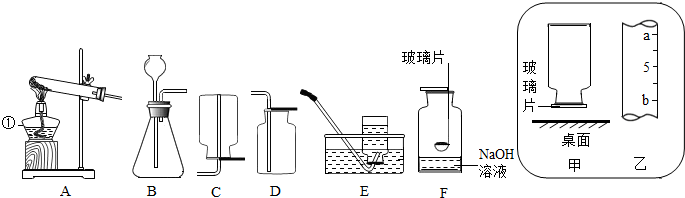
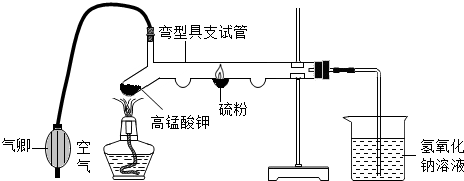
题目内容
完成上述实验时,量取水时仰视读数,则所得溶液的溶质质量分数
- A.变大
- B.变小
- C.不变
- D.无法确定
B
分析:用量筒量取水时,仰视液面,读数比实际液体体积小,会造成实际量取的水的体积偏大,据此进行分析判断.
解答:用量筒量取水时,仰视液面,读数比实际液体体积小,会造成实际量取的水的体积偏大,溶质质量不变,则会使溶质质量分数偏小.
故选B.
点评:本题难度不大,解答本题可从溶质质量分数的概念入手,与溶质和溶剂的质量有关,判断错误操作对溶质、溶剂的影响是正确解答此类题的关键.
分析:用量筒量取水时,仰视液面,读数比实际液体体积小,会造成实际量取的水的体积偏大,据此进行分析判断.
解答:用量筒量取水时,仰视液面,读数比实际液体体积小,会造成实际量取的水的体积偏大,溶质质量不变,则会使溶质质量分数偏小.
故选B.
点评:本题难度不大,解答本题可从溶质质量分数的概念入手,与溶质和溶剂的质量有关,判断错误操作对溶质、溶剂的影响是正确解答此类题的关键.

练习册系列答案
相关题目
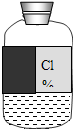 实验员小周在学期末整理实验仪器时发现有一瓶标签模糊的溶液,如下图.
实验员小周在学期末整理实验仪器时发现有一瓶标签模糊的溶液,如下图.请你和小周一起探究该溶液的成分,并测定其质量分数.
第一步:猜想并验证该溶液的溶质是什么.
猜想:根据标签可知,这瓶溶液可能是HCl、KCl、NaCl等
含有氯离子的酸或盐.
验证:
| 步骤 | 现象 | 结论 |
| 取样,滴加紫色石蕊 | 溶液变成 |
这瓶溶液是盐酸 |
实验原理:(1)用已知浓度的氢氧化钠溶液和盐酸反应,反应的化学方程式为:
NaOH+HCl=NaCl+H20
(2)当盐酸和氢氧化钠恰好完全反应时,再增加一滴氢氧化钠溶液,溶液就呈碱性(可以使无色酚酞变成红色),而一滴氢氧化钠溶液的体积约为0.05mL,对测定结果的影响很小,可忽略不计.
实验步骤:(1)取未知浓度的盐酸20g倒入烧杯中,向其中滴加2滴无色酚酞溶液.此时溶液呈
(2)量取质量分数1%的氢氧化钠溶液50mL(密度近似为1.0g/mL),用胶头滴管逐滴滴加该氢氧化钠溶液到盐酸中,观察到
数据处理:计算该盐酸溶液的溶质质量分数.
实验反思:小周在做实验的时盛放待测盐酸的烧杯(实验步骤中加点的烧杯)在装入盐酸前内壁附着较多水,用该烧杯完成上述实验会导致结果