题目内容
现有25g石灰石样品,请按下面要求计算
(1)25g样品与足量的稀盐酸反应放出8.8gCO2(杂质不溶于酸,且不与酸反应),请计算该样品的纯度(CaCO3的质量分数)是多少?_____
(2)若将25g样品平均分成两份,分别加工成块状和粉末状,将两份样品分别放入锥形瓶中,同时加入相同体积,相同浓度的足量稀盐酸充分反应,请在图象上画出块状样品与稀盐酸反应放出CO2的曲线示意图。_____
(3)若将一定质量的该石灰石样品高温煅烧,有关物质质量反应时间的变化如表所示:
时间/min | t1 | t2 | t3 | t4 | t5 |
CO2质量/g | 2.2 | 4.4 | 6.6 | 8.8 | 8.8 |
剩余固体质量/g | 22.8 | 20.6 | m | 16.2 | 16.2 |
则m=_____,t3时剩余固体中除杂质外含有的物质是_____(填化学式)
 阅读快车系列答案
阅读快车系列答案归纳总结是化学学习的一种重要方法,下列归纳和总结全部正确的一组是( )
A.关于实验及数据 | B.关于安全常识 |
①用托盘天平称量7.5g硝酸钾固体 ②用pH试纸测得溶液的pH为5.6 ③电解水实验中,得到氢气和氧气的质量比为2:1 | ①冬天用煤炉取暖要保证室内通风 ②加油站、面粉厂要严禁烟火 ③炒菜时油锅起火,迅速盖上锅盖 |
C.关于物质的鉴别 | D.关于性质和用途 |
①用肥皂水区分硬水与软水 ②用灼烧法区别黄金与黄铜(铜锌合金) ③用无色酚酞溶液区分稀盐酸和氯化钠溶液 | ①金刚石坚硬,可裁玻璃 ②氦气密度小且稳定,用于填充探空气球 ③氧气可燃,可用于气割气焊 |
A. A B. B C. C D. D
小金利用图示装置进行甲、乙对比实验,探究温度对CO和Fe2O3反应的影响(固定装置略)。
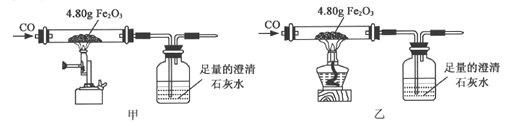
(1)从实验安全角度考虑,图示装置还应采取的改进措施是_____________。
(2)完全反应后,两组的生成物均为黑色粉末(纯净物),分别用两组生成物进行以下实验:
步骤 | 操作 | 甲组现象 | 乙组现象 |
1 | 称量黑色粉末质量/g | m1 | m2 |
2 | 取黑色粉末,用磁铁吸引 | 能被吸引 | 能被吸引 |
3 | 取黑色粉末,加入稀盐酸 | 全部溶解,有大量气泡 | 无明显现象 |
4 | 取黑色粉末,加入足量CuSO4溶液 | 有红色物质生产 | 无明显现象 |
①甲组的黑色粉末与稀盐酸反应的化学方程式是__________。
②小金查阅资料后发现Fe3O4在常温下不与稀盐酸、CuSO4溶液反应,故猜想乙组的生成物为Fe3O4。他又发现m2恰好为_______g ,这可成为支持上述猜想的新证据。
(3)甲、乙两组实验说明温度对CO和Fe2O3反应有影响,且均体现出CO的__________(填写化学性质)。





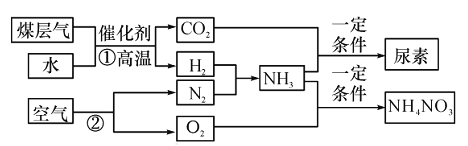
 CH3OH,由甲烷制成合成气有两种方法:
CH3OH,由甲烷制成合成气有两种方法: