题目内容
(6分)(1)天然气主要成分甲烷的化学式为CH4,按下列要求进行计算:
①甲烷的相对分子质量为 :
②甲烷中碳、氢两种元素的质量比为 。
(2)10g氢气在多少克氯气中完全燃烧,同时生成多少克氯化氢气体
(反应的化学方程式为:H2十C12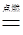 2HCl)
2HCl)
(1) ①16 ②3:l
(2)解:设消耗氯气的质量为x,生成氯化氢气体的质量为y
H2 + Cl2 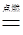 2HCl
2HCl
2 71 73
10g x y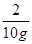 =
= =
=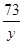
x=35.5g
y=36.5g
答:消耗氯气的质量为355g;生成氯化氢气体的质量为365g。
解析试题分析:(1)①依据相对分子质量等于各元素相对原子质量之和来解答,即甲烷的相对分子质量为12+4×1=16;
②依据物质中元素的质量比等于元素的相对原子质量之和的比来解答,甲烷中碳、氢两种元素的质量比为12:4×1=3:1;
(2)依据化学方程式的基本计算要求解答。根据氢气在氯气中燃烧生成氯化氢气体的化学方程式,可确定反应中消耗氢气与氯气,以及生成的氯化氢的质量关系,利用这一质量关系,可由参加反应氢气的质量,计算同时消耗的氯气的质量和生成氯化氢的质量。
解:设消耗氯气的质量为x,生成氯化氢气体的质量为y
H2 + Cl2 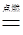 2HCl
2HCl
2 71 73
10g x y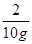 =
= =
=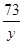
x=35.5g
y=36.5g
答:消耗氯气的质量为355g;生成氯化氢气体的质量为365g。
考点:相对分子质量的概念及其计算,元素质量比的计算,根据化学反应方程式的计算
点评:本题属基础性知识考查题,解题的关键是对有关化学式和化学方程式基本计算的掌握,根据反应的化学方程式可表示反应中各物质的质量关系,由反应中任意一种物质的质量可计算出反应中其它物质的质量。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 2HCl)
2HCl) 2HCl)
2HCl)