题目内容
【题目】食盐不仅是人类不可替代的食用调味品,而且是一种重要的化工原料,被称为“化学工业之母”,比如可以用来制盐酸,下面是其工艺流程:
①把固体食盐溶解在水中形成饱和粗盐水,除去钙镁离子、天然有机物及难溶物等杂质,将精制后的合格盐水送入电解槽,通直流电进行电解,产生氯气、氢气和烧碱(NaOH)
2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
②将氢气、氯气处理合格后,送至合成炉内进行燃烧合成反应H2+Cl2 ![]() 2HCl
2HCl
③生成的氯化氢气体在吸收器内溶于水得到盐酸,某化工厂日生产氯气146t,计算每天可以制得氯化氢气体的质量是多少?(结果保留2位小数)
【答案】解:设生成氯化氢气体的质量为x.
H2+Cl2![]() 2HCl
2HCl
71 73
146t x
则 ![]() ,
,
解得x=150.11t.
答:每天可以制得氯化氢气体的质量是150.11t
【解析】根据“将精制后的合格盐水送入电解槽,通直流电进行电解,产生氯气、氢气和烧碱(NaOH),2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑”、“将氢气、氯气处理合格后,送至合成炉内进行燃烧合成反应H2+Cl2
2NaOH+H2↑+Cl2↑”、“将氢气、氯气处理合格后,送至合成炉内进行燃烧合成反应H2+Cl2 ![]() 2HCl”.则根据化学方程式,可以计算某化工厂日生产氯气146t,制得氯化氢气体的质量.
2HCl”.则根据化学方程式,可以计算某化工厂日生产氯气146t,制得氯化氢气体的质量.

 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案【题目】同学们在学碱的化学性质时,做了一个如图所示的甲乙两个实验. 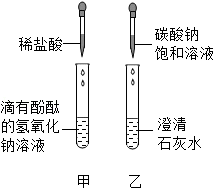
(1)写出乙实验的化学反应方程式 , 反应过程中产生的现象是 . 实验结束后,甲、乙两个同学将废液倒入实验室的废液缸,结果发现废液浑浊并呈红色,产生疑问.
(2)【提出问题】废液中含有哪些物质? 【交流讨论】①一定含有的物质:碳酸钙、指示剂、水和(写物质名称).
②还含有能使废液呈碱性的物质.能使废液呈碱性的物质是什么?同学们有如下猜想.
小云认为:只有碳酸钠
小红认为:只有氢氧化钙
小林认为:是氢氧化钠和碳酸钠
你认为还可能是 . (写一种猜想)
(3)【实验设计】小方想用氯化钙溶液来验证小云、小红、小林的猜想.查阅资料获悉氯化钙溶液呈中性,并设计如下实验.请你将小方的实验设计补充完整.
实验内容 | 预计现象 | 预计结论 |
取少量废液缸中上层清液于试管中,加入过量氯化钙溶液,静置. | ①有白色沉淀,溶液呈红色. | 的猜想正确. |
② . | 的猜想正确. | |
③ . | 的猜想正确. |
(4)【反思拓展】在分析化学反应后所得物质的成分时,除了考虑生成物外还需考虑 .