题目内容
【题目】有一包白色粉末可能含有硫酸钡、碳酸钾和氢氧化钡中的一种或几种,取一定量该粉末加入到盛有足量水的烧杯中,搅拌、静置,观察到烧杯中有白色不溶物。
友情提示:氯化钡溶液为中性。
(1)不能确定白色粉末中一定含有硫酸钡,其理由(化学方程式表示) 。
(2)进一步确定白色固体成分,进行如下实验探究:

Ⅰ.步骤②中发生化学反应的方程式是 ;
Ⅱ.
实验操作 | 现象 | 结论 |
步骤③中,加入酚酞溶液 | 若溶液E为无色 | 原白色粉末的组成是 ; |
若溶液E为红色 | 滤液A中一定含有的溶质是 , 原白色粉末的可能组成分别是 。 |
(3)取少量滤渣B,加入过量的稀硝酸,若看到的现象是 , 就足以说明原白色粉末中只含有碳酸钾和氢氧化钡。
【答案】(1) Ba(OH)2 + K2CO3 →BaCO3↓ + 2KOH(2) Ⅰ.BaCl2+ K2CO3 → BaCO3↓+ 2KCl
Ⅱ. BaSO4 K2CO3 , K2CO3 KOH , K2CO3 Ba(OH)2 或 K2CO3 Ba(OH)2 BaSO4
(3)白色沉淀全部溶解,有气泡产生。
【解析】
试题分析:(1)碳酸钾与氢氧化钡在溶液反应生成碳酸钡白色沉淀和氢氧化钾;填:K2CO3+Ba(OH)2=BaCO3↓+2KO H;
(2)碳酸钾与氯化钡溶液反应生成氯化钾和碳酸钡白色沉淀;故填:BaCl2+K2CO3=BaCO3↓+2KCl;
(3)步骤③中,加入酚酞溶液后,若溶液E为无色,说明反应后的溶液呈中性,也就是说碳酸钾被完全转化为沉淀,而原混合物中不含氢氧化钡,故填:BaSO4、K2CO3;
步骤③中加入酚酞溶液后,若溶液E为红色,说明原混合物中有氢氧化钡,碳酸钾与氢氧化钡反应生成碳酸钡沉淀和氢氧化钾.根据后面加入氯化钡后产生白色沉淀说明碳酸钾较多;故填:K2CO3、KOH;
根据现象可知,原混合物可能是氢氧化钡和碳酸钾组成的,也可能是硫酸钡、氢氧化钡和碳酸钾组成的;故填:K2CO3 Ba(OH)2 或 K2CO3 Ba(OH)2 BaSO4
(3)白色沉淀可能是硫酸钡,也可能是碳酸钡,也可能是硫酸钡与碳酸钡的混合物,其中硫酸钡不与稀硝酸反应,而碳酸钡能与稀硝酸反应生成硝酸钡、水和二氧化碳

【题目】某同学利用“多米诺骨牌”效应,设计了如图气体制取与性质验证的组合实验,打开A中分液漏斗的活塞,很快看到E中导管口有气泡冒出,且溶液由紫色变红色。 请看图回答问题:
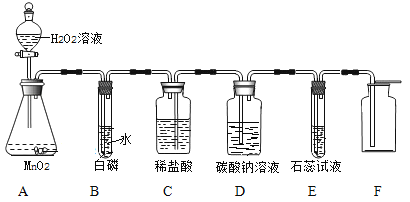
(1)A中反应的化学方程式 ;
B中白磷不燃烧,原因是 。
(2)C、D中看到的现象分别是 、
。
(3)用化学方程式表示E中颜色变化的原因 。
(4)将D中液体倒入试管中,对其成分进行探究:
实验操作 | 实验现象 | 结论 |
方法一:向试管中滴入 溶液 | 无色液体变白色浑浊 | 溶质中一定含有 碳酸钠和 |
方法二:向试管中放入镁条 | 气泡产生 |

