题目内容
【题目】医用氯化钙可用于补钙、抗过敏和消炎等,以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医用二水合氯化钙工艺流程为: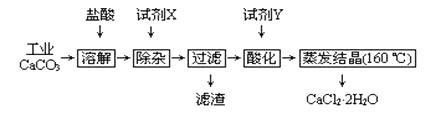
已知:查阅资料得知氢氧化物沉淀时的pH为:
氢氧化物 | Fe(OH)3 | Al(OH)3 | |
开始沉淀时的pH | 2.3 | 4.0 | 开始溶解:7.8 |
完全沉淀时的pH | 3.7 | 5.2 | 完全溶解:10.8 |
(1)CaCO3与盐酸反应的化学方程式。
(2)除杂操作是加入试剂X,调节溶液的pH范围应为(提示:找出pH范围的两个边界值,并选择适当的数学符号“<、>、≤、≥”,组成形如 “边界值1<pH<边界值2” 等等的不等式来表示pH范围),其目的是。试剂X最好选用(选填序号)
a.Ca(OH)2 b.NaOH c.NH3 d.Na2CO3
(3)过滤时需用的玻璃仪器烧杯、、。
(4)酸化的目的是:。所加试剂Y名称为。
(5)蒸发结晶时要保持在160℃,为什么温度不能太高: 。
(6)若所得样品CaCl2·2H2O的氯元素质量分数偏高(忽略其他实验误差),其可能原因之一是。
【答案】
(1)CaCO3+ 2HCl =CaCl2 + CO2↑+ H2O
(2)5.2≤PH<7.8,使溶液中Al3+、Fe3+完全转化为沉淀除去,a
(3)玻璃棒,普通漏斗
(4)除去过量的氢氧化钙(合理则给分),稀盐酸
(5)温度太高CaCl2 ·2H2O会失水
(6)样品中混有NaCl(或少量的CaCl2·2H2O失水)
【解析】根据所学知识和题中信息知,(1)CaCO3与盐酸反应的化学方程式是. CaCO3+ 2HCl =CaCl2 + CO2↑+ H2O。(2)除杂操作是加入试剂X,调节溶液的pH范围应为5.2≤PH<7.8 。其目的是使溶液中Al3+、Fe3+完全转化为沉淀除去。试剂X最好选用a.Ca(OH)2 。 (3)过滤时需用的玻璃仪器烧杯、玻璃棒,普通漏斗。(4)酸化的目的是:除去过量的氢氧化钙。所加试剂Y名称为稀盐酸。(5)蒸发结晶时要保持在160℃,为什么温度不能太高:温度太高CaCl2 ·2H2O会失水。(6)若所得样品CaCl2·2H2O的氯元素质量分数偏高(忽略其他实验误差),其可能原因之一是样品中混有NaCl(或少量的CaCl2·2H2O失水)。
所以答案是:CaCO3+ 2HCl =CaCl2 + CO2↑+ H2O、5.2≤PH<7.8、使溶液中Al3+、Fe3+完全转化为沉淀除去、a、玻璃棒、普通漏斗、除去过量的氢氧化钙(合理则给分)、稀盐酸、温度太高CaCl2 ·2H2O会失水、样品中混有NaCl(或少量的CaCl2·2H2O失水)。

 阶梯计算系列答案
阶梯计算系列答案